题目内容
10.下列有关仪器的使用方法或实验操作正确的是( )| A. | 用陶瓷坩埚熔化氢氧化钠固体 | |
| B. | 用碱式滴定管准确量取15.00mLKMnO4溶液 | |
| C. |  用如图所示操作排除碱式滴定管中的气泡 | |
| D. | 用苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出 |
分析 A.陶瓷坩埚的主要成分是二氧化硅;
B.高锰酸钾溶液具有强氧化性;
C.挤压时尖嘴向上,易于空气排出;
D.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出.
解答 解:A.陶瓷坩埚的主要成分是二氧化硅,二氧化硅可与氢氧化钠反应生成硅酸钠,故A错误;
B.高锰酸钾溶液具有强氧化性,应放在酸式滴定管中,故B错误;
C.挤压时尖嘴向上,易于空气排出,图中挤压橡胶管中的操作合理,故C正确;
D.用苯萃取溴水中的溴,苯的密度比水小在上层,根据分液漏斗的使用原则,分液时,分液漏斗中下层水先从下口放出,有机层后从分液漏斗的上端倒出,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、称量、分液等,综合性较强,侧重实验基础知识及实验技能的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案
相关题目
20.A、B、C、D、E是同周期主族元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是
( )
( )
| A. | E、C、D、B、A | B. | D、B、C、A、E | C. | E、B、A、D、C | D. | A、B、C、D、E |
1.铋元素可表示为 83Bi,在元素周期表中相对原子质量标示为209.0,下列说法正确的是( )
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi原子最高价氧化物的水化物酸性比硝酸的要强 | |
| D. | Bi元素位于元素周期表第六周期第ⅤA族 |
18.向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成.经查资料得知:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O.下列分析不正确的是( )
| A. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+CI-(aq) | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 实验表明实验室可用氨水洗涤银镜反应后的试管 | |
| D. | 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |
5.在常温时,将V1mLc1mol•L-1CH3COOH溶液中滴加到V2mLc2mol•L-1NaOH溶液中,下列结论中,错误的是( )
| A. | 如果V1=V2,c1=c2,则混合溶液中c(CH3COO-)=c(Na+) | |
| B. | 如果混合溶液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) | |
| C. | 如果混合溶液的pH>7,则不可能V1c1=V2c2 | |
| D. | 如果V1=V2,且混合溶液的pH<7,则c1>c2 |
15.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )


| A. | 分子中所有原子在同一平面上 | |
| B. | 分子中含有2种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出H+ |
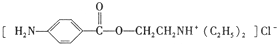 )是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下:
)是一种局部麻醉剂,麻醉作用较快、较强,毒性较低,其合成路线如下: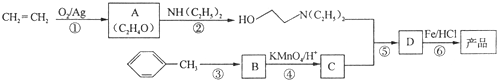
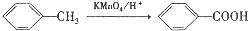
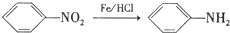
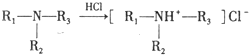
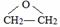 .
.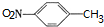 ,C中含氧官能团的名称为硝基、羧基.
,C中含氧官能团的名称为硝基、羧基.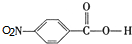 +HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$
+HOCH2CH2N(C2H5)2$\stackrel{一定条件下}{→}$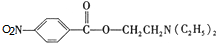 +H2O.
+H2O.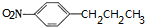 (任写一种).
(任写一种).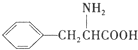 )是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式
)是人体必需的氨基酸之一,写出其发生缩聚反应的化学方程式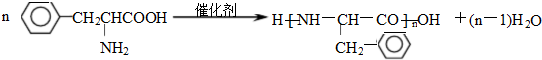 .
.