题目内容
5.若将14Si的电子排布式写成1s22s22p63s23p${\;}_{x}^{2}$,它违背了( )| A. | 能量守恒原理 | B. | 泡利原理 | C. | 能量最低原理 | D. | 洪特规则 |
分析 能量最低原理:原子核外电子先占有能量低的轨道,然后依次进入能量高的轨道;
泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子;
洪特规则:洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.
解答 解:Si原子3p能级上有3个轨道,3p能级上有2个电子,2个电子应该排在2个不同的轨道上,且自旋方向相同,若将Si原子的电子排布式写成1s22s22p63s23px2,它违背了洪特规则,正确的电子排布式为:1s22s22p63s23px13py1,故选D.
点评 本题考查了原子结构构造原理,明确这几个概念是解本题关键,难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
15.下列电子式正确的是( )
| A. |  | B. | 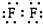 | C. |  | D. |  |
16.已知有两种只含碳、氢两种元素的化合物,二者的分子中碳的质量分数相同,则下列说法正确的是( )
| A. | 这两种烃一定是同分异构体 | |
| B. | 这两种烃不可能是同系物 | |
| C. | 在这两种烃的分子中,碳、氢原子个数之比一定相同 | |
| D. | 这两种烃各1mol完全燃烧,生成水的质量一定相等 |
13.下列图示与对应的叙述相符的是( )
| A. | 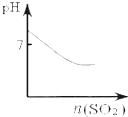 可表示将SO2气体通入氯水时pH的变化 | |
| B. |  表示KNO3的溶解度曲线,a点是80℃的KNO3的不饱和溶液 | |
| C. | 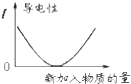 表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 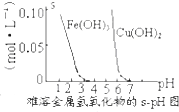 根据图,除去CuSO4溶液中Fe3+,可加氨水调节pH=4 |
20.A、B、C、D、E是同周期主族元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是
( )
( )
| A. | E、C、D、B、A | B. | D、B、C、A、E | C. | E、B、A、D、C | D. | A、B、C、D、E |
10.能证明铝的金属性比镁弱的实验事实是( )
| A. | Al(OH)3能溶于NaOH溶液,而Mg(OH)2不能 | |
| B. | 铝的原子半径比镁小 | |
| C. | 镁与浓硫酸反应,铝与冷的浓硫酸不反应 | |
| D. | 铝的金属光泽不如镁显著 |
17.同分异构体数目与C6H14相同的化合物是( )
| A. | C4H8 | B. | C4H9Cl | C. | C4H10O | D. | C4H8O2 |
14.X、Y、Z、W是短周期元素,原子序数依次递增,Y、Z、W原子的最外层电子数之和为14,X与Z位于同一主族,Y元素单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | X、Z、W氧化物对应水化物酸性的强弱顺序为Z<X<W | |
| C. | 室温下,含Y元素的盐形成的水溶液其pH<7 | |
| D. | Z元素的单质和氧化物均既能与NaOH溶液反应也能与某种酸反应 |
15.莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是( )


| A. | 分子中所有原子在同一平面上 | |
| B. | 分子中含有2种官能团 | |
| C. | 可发生加成和取代反应 | |
| D. | 在水溶液中羟基和羧基均能电离出H+ |