题目内容
9.下列装置不能完成相应实验的是( )| A. |  装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  装置可除去CO2中少量的SO2杂质 | |
| C. | 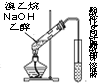 装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 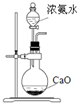 装置可用于实验室制备氨气 |
分析 A.可根据最高价氧化物对应的水化物的酸性强弱比较非金属性强弱;
B.二者均与饱和碳酸钠溶液反应;
C.不能排出乙醇的干扰;
D.氧化钙与水反应是放热反应.
解答 解:A.锥形瓶内生成气体,可证明硫酸的酸性比碳酸强,烧杯生成沉淀,可证明碳酸的酸性比硅酸强,酸性越强,对应的元素的非金属性越强,故A正确;
B.二者均与饱和碳酸钠溶液反应,不能除杂,故B错误;
C.乙醇易挥发,不能排出乙醇的干扰,故C错误;
D.氧化钙与水反应是放热反应,可用来制取氨气,故D正确.
故选BC.
点评 本题考查实验方案的评价,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,注意物质的性质的差异,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.A、B、C、D、E是同周期主族元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是
( )
( )
| A. | E、C、D、B、A | B. | D、B、C、A、E | C. | E、B、A、D、C | D. | A、B、C、D、E |
17.同分异构体数目与C6H14相同的化合物是( )
| A. | C4H8 | B. | C4H9Cl | C. | C4H10O | D. | C4H8O2 |
4.下列物质的制备中,不符合工业生产实际的是( )
| A. | NH3$→_{催化剂}^{O_{2}}$NO$\stackrel{O_{2}}{→}$ NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | 浓缩海水$\stackrel{Cl_{2}}{→}$Br2$\stackrel{SO_{2}}{→}$ HBr$\stackrel{Cl_{2}}{→}$ Br2 | |
| C. | 饱和食盐水$\stackrel{电解}{→}$Cl2$\stackrel{Ca(OH)_{2}}{→}$ 漂白粉 | |
| D. | H2和Cl2混合气体$\stackrel{光照}{→}$HCl气体$\stackrel{水}{→}$ 盐酸 |
14.X、Y、Z、W是短周期元素,原子序数依次递增,Y、Z、W原子的最外层电子数之和为14,X与Z位于同一主族,Y元素单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,下列说法正确的是( )
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | X、Z、W氧化物对应水化物酸性的强弱顺序为Z<X<W | |
| C. | 室温下,含Y元素的盐形成的水溶液其pH<7 | |
| D. | Z元素的单质和氧化物均既能与NaOH溶液反应也能与某种酸反应 |
1.铋元素可表示为 83Bi,在元素周期表中相对原子质量标示为209.0,下列说法正确的是( )
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi原子最高价氧化物的水化物酸性比硝酸的要强 | |
| D. | Bi元素位于元素周期表第六周期第ⅤA族 |
18.向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成.经查资料得知:Ag++2NH3•H2O?[Ag(NH3)2]++2H2O.下列分析不正确的是( )
| A. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+CI-(aq) | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 实验表明实验室可用氨水洗涤银镜反应后的试管 | |
| D. | 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |

