题目内容
11.在元素周期表中,某些主族元素与右下方主族元素的有些性质是相似的,被称为“对角线”规则,如:Li和Mg、Be和Al、B和Si.下列说法不正确的是( )| A. | Li在N2中燃烧生成Li3N | |
| B. | LiOH是极易溶的强碱 | |
| C. | Be(OH)2既能溶于强酸又能溶于强碱溶液 | |
| D. | 硼酸钠溶液显碱性 |
分析 根据对角线规则知,Li元素和Mg元素性质相似,Be和Al元素的性质相似,根据Mg元素及其化合物的性质判断Li元素及其化合物的性质,根据Al元素及其化合物的性质判断Be元素及其化合物的性质.
解答 解:A.镁和氮气反应生成氮化镁,根据对角线规则知,Li和氮气反应生成Li3N,故A正确;
B.氢氧化镁为难溶于水的弱碱,据此得出LiOH是难溶于水的弱碱,故B错误;
C.氢氧化铝能溶于强酸和强碱,根据对角线规则知,氢氧化铍能溶于强酸和强碱,故C正确;
D.B和Si性质相似,硅酸钠溶液显碱性,根据对角线规则知,硼酸钠显碱性,故D正确;
故选:B.
点评 本题考查了物质的性质,明确对角线规则的含义是解本题关键,根据对角线规则来分析解答即可,难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
16.已知有两种只含碳、氢两种元素的化合物,二者的分子中碳的质量分数相同,则下列说法正确的是( )
| A. | 这两种烃一定是同分异构体 | |
| B. | 这两种烃不可能是同系物 | |
| C. | 在这两种烃的分子中,碳、氢原子个数之比一定相同 | |
| D. | 这两种烃各1mol完全燃烧,生成水的质量一定相等 |
20.A、B、C、D、E是同周期主族元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是
( )
( )
| A. | E、C、D、B、A | B. | D、B、C、A、E | C. | E、B、A、D、C | D. | A、B、C、D、E |
1.铋元素可表示为 83Bi,在元素周期表中相对原子质量标示为209.0,下列说法正确的是( )
| A. | Bi元素的质量数是209 | |
| B. | Bi元素最高价氧化物的化学式为Bi2O3 | |
| C. | Bi原子最高价氧化物的水化物酸性比硝酸的要强 | |
| D. | Bi元素位于元素周期表第六周期第ⅤA族 |
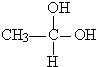 →CH3-CHO+H2O
→CH3-CHO+H2O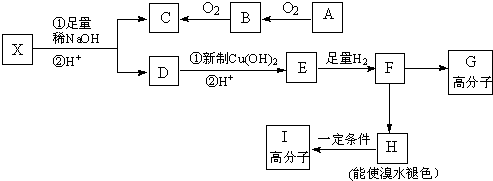
 ;
; ;
; ;
;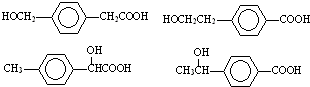 .
.
