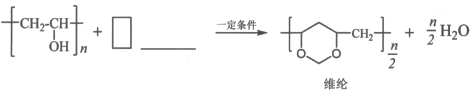
题目内容
10.下列说法正确的是( )| A. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 | |
| B. | 用电解NaCl溶液的方法来冶炼金属钠 | |
| C. | 有些活泼金属如铝可用作热还原法的还原剂 | |
| D. | 金属在地壳中含量很高,回收废旧金属浪费人力物力 |
分析 金属的活泼性不同,冶炼方法不同,K、Ca、Na、Mg、Al等金属可用电解法冶炼,Zn、Fe、Sn、Pb、Cu、Hg等金属可用热还原法冶炼,Ag、Hg等金属可用热分解法冶炼,热还原法的还原剂可用C、CO等,如冶炼温度较高,可用Al为还原剂,以此解答该题.
解答 解:A.铝为活泼金属,应用电解熔融的氧化铝的方法冶炼,故A错误;
B.冶炼金属钠,应用电解熔融的氯化钠的方法,电解氯化钠溶液得到氢氧化钠、氢气和氯气,故B错误;
C.Al可用作铝热反应的还原剂,可用于冶炼铁等金属,用于焊接钢轨,故C正确;
D.因为金属为不可再生资源,回收旧金属可进行冶炼生成金属单质,也可用于制备其它化工产品,如回收铁、铝等,所以回收废旧金属很有应用价值,故D错误.
故选C.
点评 本题考查金属的冶炼,侧重于基础知识的考查,注意把握金属的冶炼方法和金属活泼性之间的关系,难度不大.

练习册系列答案
相关题目
5.已知草酸(H2C2O4)为二元弱酸,酸性比碳酸强.下列有关叙述正确的是( )
| A. | 草酸稀溶液加水稀释,溶液中所有离子浓度均减小 | |
| B. | NaHC2O4溶液中有:2c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) | |
| C. | pH=3的草酸与pH=12的NaOH溶液混合至中性时,溶液中有:c(Na+)=c(HC2O4-)+2c(C2O42-) | |
| D. | 等浓度的草酸和碳酸相比,溶液中由水电离出来的c(H+)前者更多 |
15.下列电子式正确的是( )
| A. | 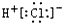 | B. | 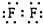 | C. | 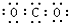 | D. |  |
2.下列说法正确的是( )
| A. | 在Na2S溶液中:c(Na+)=c(HS-)+c(S2-) | |
| B. | 乙烯的燃烧热为akJ•mol-1(a>0),则乙烯燃烧的热化学方程式可表示为C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-akJ•mol-1 | |
| C. | 钢铁发生吸氧腐蚀的正极反应式为O2+4e-+2H2O=4OH- | |
| D. | 从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH- |
20.A、B、C、D、E是同周期主族元素,A、B的最高价氧化物的水化物呈碱性,且B比A的碱性强,C、D最高价氧化物水化物是酸,且C比D的酸性强,E是这五种元素中半径最大的,则它们的原子序数由小到大的顺序是
( )
( )
| A. | E、C、D、B、A | B. | D、B、C、A、E | C. | E、B、A、D、C | D. | A、B、C、D、E |
 ,请按要求完成下列问题:
,请按要求完成下列问题: ;
; .
. .
.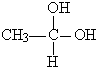 →CH3-CHO+H2O
→CH3-CHO+H2O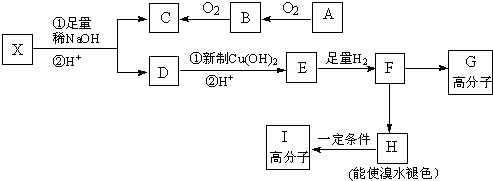
 ;
;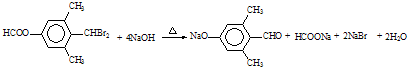 ;
;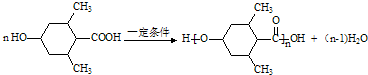 ;
; .
.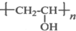 ,其工业合成路线如下:
,其工业合成路线如下: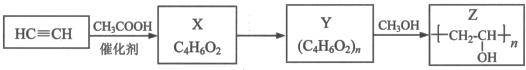
 ;
;