题目内容
【题目】水合肼是无色、有强还原性的液体,实验室制备水合肼的原理为:CO(NH2)2+2NaOH+NaClO==Na2CO3+N2H4·H2O+NaCl 据此,某学生设计了下列实验。
(制备NaClO溶液)
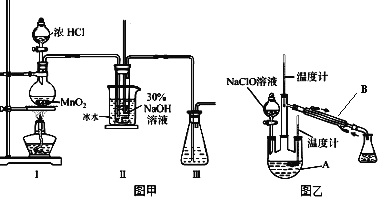
实验装置如图甲所示部分夹持装置已省略
已知:3NaClO![]() 2NaCl+NaClO3
2NaCl+NaClO3
(1)请写出肼的电子式_________________。
(2)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有___________。
(3)装置I中发生的化学反应方程式是 ____________________________;Ⅱ中用冰水浴控制温度在30℃以下,其主要目的是______________________________。
(制取水合肼)
实验装置如图乙所示。
(4)仪器B的名称为_________;反应过程中,如果分液漏斗中溶液的滴速过快,部分N2H4·H2O参与A中反应并产生大量氮气,请写出该反应的化学反应方程式_________________。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是_____________________。
(测定肼的含量)
称取馏分0.2500g,加水配成20.00mL溶液,在一定条件下,以淀粉溶液做指示剂,用0.1500 mol·L-1的I2溶液滴定。
已知:N2H4·H2O+2I2==N2↑+4HI+H2O
滴定终点时的现象为_____________________________________。实验测得消耗I2溶液的平均值为20.00 mL,馏分中N2H4.H2O的质量分数为______。
【答案】![]() 烧杯、玻璃棒 MnO2+4HCl(浓)
烧杯、玻璃棒 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 防止温度过高次氯酸钠变为氯化钠和氯酸钠 直形冷凝管 N2H4·H2O+2NaClO====2NaCl+N2↑+3H2O 冷却后补加 滴定终点时的现象为当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失。 30.0%
MnCl2+Cl2↑+2H2O 防止温度过高次氯酸钠变为氯化钠和氯酸钠 直形冷凝管 N2H4·H2O+2NaClO====2NaCl+N2↑+3H2O 冷却后补加 滴定终点时的现象为当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失。 30.0%
【解析】
(1)肼是共价化合物,原子之间通过共价键结合,则肼的电子式为:![]() 。本小题答案为:
。本小题答案为:![]() 。
。
(2)配制30%的NaOH溶液时,用天平称量质量,在烧杯中加水溶解,并用玻璃棒搅拌,需要玻璃仪器有:烧杯、玻璃棒。本小题答案为:烧杯、玻璃棒。
(3)二氧化锰与浓盐酸反应生成氯化锰、氯气与水,化学反应方程式为:![]() 。温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,所以步骤Ⅰ温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠。本小题答案为:
。温度升高时,次氯酸钠容易发生自身的氧化还原反应生成氯酸钠和氯化钠,所以步骤Ⅰ温度需要在30℃以下,其主要目的是防止NaClO(歧化)分解为氯酸钠和氯化钠。本小题答案为:![]() ;防止温度过高次氯酸钠变为氯化钠和氯酸钠。
;防止温度过高次氯酸钠变为氯化钠和氯酸钠。
(4)仪器B为直形冷凝管。![]() 具有强还原性,容易被过量的NaClO氧化,发生的反应为:
具有强还原性,容易被过量的NaClO氧化,发生的反应为:![]() 。本小题答案为:直形冷凝管;
。本小题答案为:直形冷凝管;![]() 。
。
(5)充分反应后,加热蒸馏烧瓶A内的溶液即可得到水合肼的粗产品。若在蒸馏刚刚开始的时候忘记添加沸石,应该采取的操作是冷却后补加。碘的标准溶液与肼反应完全,再滴入碘的标准溶液后,遇淀粉变蓝色,实验滴定终点的现象为:当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失。
设馏分中水合肼的质量分数为α,则
N2H4·H2O + 2I2==N2↑+4HI+H2O
1mol 2mol
![]()
![]()
计算得出α=30.0%
本小题答案为:冷却后补加;滴定终点时的现象为当加入最后一滴滴定剂的时候,溶液出现蓝色且半分钟内不消失;30.0%。

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案