题目内容
【题目】化学中存在一些守恒或平衡原理,下列叙述正确的是
A. 根据质量(原子)守恒定律,某物质完全燃烧的产物是CO2和H2O则该物质一定是烃
B. 根据能量守恒定律,所有化学反应的反应物的总能量一定等于生成物的总能量
C. 根据电子守恒定律,原电池中负极反应失电子数一定等于正极反应得电子数
D. 根据化学平衡原理,可逆反应的正反应速率在任何时刻一定等于逆反应速率
【答案】C
【解析】
A不正确,因为无法判断是否含有氧元素。B不正确,因为任何化学反应都伴随着能量的变化,即反应物的总能量一定不等于生成物的总能量。可逆反应中只有达到平衡状态时,正逆反应速率才是相等的,D不正确。答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
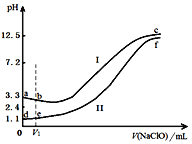
【题目】向两份等体积、等浓度,pH不同的FeSO4溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法不正确的是
实验 | 实验现象 |
Ⅰ | 滴入V1mL NaClO溶液产生大量红褐色沉淀 |
Ⅱ | 滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褐色沉淀 |
A. a~b段主要反应的离子方程式为:2Fe2+ + ClO-+5H2O===2Fe(OH)3↓+Cl-+4H+
B. d~e段主要反应的离子方程式为:2Fe2++2ClO-+3H+=== HClO + Cl-+ 2Fe3+ + H2O
C. c、f点pH接近的主要原因是:ClO-+ H2O![]() HClO + OH-
HClO + OH-
D. 向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出