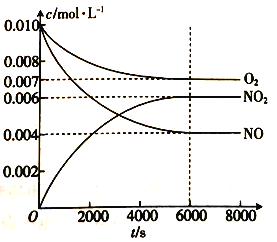
题目内容
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150ml 4mol/L的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
A. 0.21 mol
B. 0.25 mol
C. 0.3 mol
D. 0.35 mol
【答案】B
【解析】
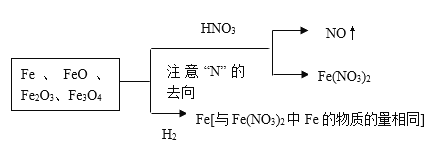
混合物与稀硝酸恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明Fe元素以Fe(NO3)2形式存在,根据信息得出: ,因此有n(Fe)=n[Fe(NO3)2]=[n(HNO3)-n(NO)]/2=[150×10-3×4-2.24/22.4]/2mol=0.25mol,故选项B正确。
,因此有n(Fe)=n[Fe(NO3)2]=[n(HNO3)-n(NO)]/2=[150×10-3×4-2.24/22.4]/2mol=0.25mol,故选项B正确。

【题目】工业上从电解精炼铜的阳极泥(成分为CuS、Cu2Se、Cu2Te 和少量金属单质Au) 中回收碲、硒的工艺流程如下:
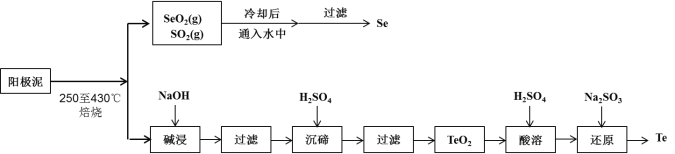
已知:①TeO2是两性氧化物。
②Se和TeO2的物理性质如下:
物理性质 | 熔点 | 沸点 | 水溶性 |
Se | 221℃ | 685℃ | 难溶于水 |
TeO2 | 733℃ | 1260℃ | 微溶于水 |
(1)Se在周期表中的位置为____________。
(2)SeO2与SO2的混合烟气可用水吸收制得单质Se,当有2 mol电子转移时,会生成______mol Se。过滤所得粗硒可采用真空蒸馏的方法提纯获得纯硒,采用真空蒸馏的目的是_______________。
(3)“碱浸”过滤得到滤渣的主要成分是_______(填化学式)。
(4)“沉碲”时控制溶液的pH为4.5-5.0,生成TeO2沉淀。如果H2SO4的浓度过大,将导致“沉碲”不完全,原因为_______________________________________。
(5)“酸溶”将TeO2先溶于硫酸得到Te(SO4)2,然后加入Na2SO3溶液进行还原,还原碲的离子反应方程式是_______________________________________。
(6)常温下,SeO2与NaOH溶液反应所得NaHSeO3溶液的pH______7(填“>”“<”或“=”),请通过计算说明_____________________________。(已知25℃时,亚硒酸(H2SeO3)的Ka1=2.5×10-3,Ka2=2.5×10-7)