题目内容
【题目】近几年我国大面积发生雾霾天气,其主要原因是SO2、NOx等挥发性有机物等发生二次转化,研究碳、氮、硫及其化合物的转化对于环境的改善有重大意义。
(1)在一定条件下,CH4可与NOx反应除去NOx,已知有下列热化学方程式:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ·mol-1
②N2(g)+2O2(g)![]() 2NO2(g) △H=+67.0 kJ·mol-1
2NO2(g) △H=+67.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-41.0 kJ·mol-1
则CH4(g)+2NO2(g) ![]() CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在____(高温,低温,任何温度)下可自发进行
CO2(g)+2H2O(g)+N2 (g) △H=____kJ·mol-1;该反应在____(高温,低温,任何温度)下可自发进行
(2)SO2经过净化后与空气混合进行催化氧化可制取硫酸,其中SO2发生催化氧化的反应为: 2SO2(g)+O2(g) ![]() 2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_____________。
2SO3(g) △H< 0,在一定温度下的定容容器中,能说明上述平衡达到平衡状态的是:_____________。
A. 混合气体的密度不再发生变化 B.混合气体的平均摩尔质量不再发生变化
C. ![]() (SO2):
(SO2):![]() (O2):
(O2):![]() (SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
(SO3)=2:1:2 D.混合气体的总物质的量不再发生变化
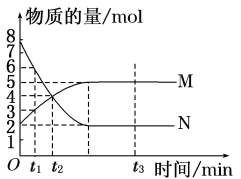
(3)若在T1℃、0.1 MPa条件下,往一密闭容器通入SO2和O2 [其中n(SO2):n(O2)= 2:1],测得容器内总压强与反应时间如下图所示。
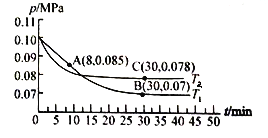
①图中A点时,SO2的转化率为________。
②在其他条件不变的情况下,测得T2℃时压强的变化曲线如图所示,则C点的正反应速率![]() 0(正)与A点的逆反应速率
0(正)与A点的逆反应速率![]() A(逆)的大小关系为
A(逆)的大小关系为![]() 0(正)_____
0(正)_____![]() A(逆) (填“>"、“<”或“ = ”)。
A(逆) (填“>"、“<”或“ = ”)。
③图中B点的平衡常数Kp=______。(Kp=压强平衡常数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)为了清除NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理。现有由a mol NO、b molNO2、c molN2O4组成的混合气体恰好被VL氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为____________。
【答案】-875.3 任何温度下 BD 45% > 24300 (a+b+2c)/V mol·L-1
【解析】
(1)根据盖斯定律,反应①-②-2×③得到最终的反应方程式,得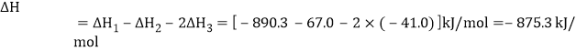 ;从热化学反应方程式看,此反应是一个熵增的放热反应,在任何温度下都可自发进行,本小题答案为:-875.3;任何温度下;
;从热化学反应方程式看,此反应是一个熵增的放热反应,在任何温度下都可自发进行,本小题答案为:-875.3;任何温度下;
(2)A.此反应中参与反应的气体总质量不变且在定容容器中进行,则混合气体的密度始终保持不变,混合气体密度不变不能说明达到平衡状态,故A错误;
B.此反应中参与反应的气体总质量不变,反应后气体总物质的量是变化的,则混合气体的平均摩尔质量也是变化的,混合气体的平均摩尔质量不再变化能说明达到平衡状态,故B正确;
C.无论反应是否达到平衡状态,SO2、O2、SO3三者速率之比都等于化学计量数之比,则C项不能说明达到平衡状态,故C错误;
D.此反应是反应前后总物质的量变化的反应,混合气体的总物质的量不再变化能说明达到平衡状态,故D正确,答案选BD;
(3)①设SO2和O2初始投料分别为2n和n,转化的SO2和O2物质的量分别为2x和x,列式计算
SO2 O2 SO3
初始物质的量/mol 2n n 0
转化物质的量/mol 2x x 2x
平衡物质的量/mol 2n-2x n-x 2x
![]() ,得
,得![]() ,本小题答案为45%;
,本小题答案为45%;
②首先比较A、B两点的逆反应速率,随反应的进行逆反应速率逐渐增大,B的逆反应速率大于A的逆反应速率,B、C两点的正逆反应速率分别相等,T2时反应比T1先到达平衡,证明T2>T1,则C点反应速率大于B点反应速率,所以![]() ,本小题答案为:>;
,本小题答案为:>;
③类比于①中的计算![]() ,x=0.9n,平衡分压为
,x=0.9n,平衡分压为![]() ,
,![]() ,
,![]() ,
,![]() 。本小题答案为:24300;
。本小题答案为:24300;
(4)混合气体发生的反应是:![]() ,
,![]() ,
,![]() ,全部吸收最少消耗的NaOH物质的量为2a+(b-a)+2c=(a+b+2c)mol,所以浓度为
,全部吸收最少消耗的NaOH物质的量为2a+(b-a)+2c=(a+b+2c)mol,所以浓度为![]() ,本小题答案为:
,本小题答案为: ![]() 。
。