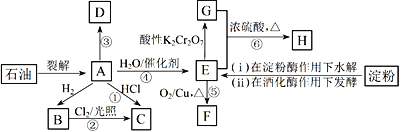
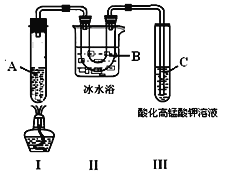
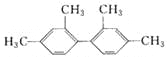
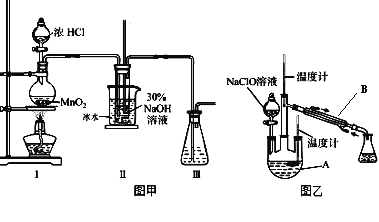
题目内容
【题目】已知HA的酸性弱于HB的酸性。25℃时,用NaOH固体分别改变物质的量浓度均为0.1 molL-1的HA溶液和HB溶液的pH(溶液的体积变化忽略不计),溶液中A-、B-的 物质的量浓度的负对数与溶液的pH的变化悄况如图所示。

下列说法正确的是( )
A. 曲线Ⅰ表示溶液的pH与-lgc(A-)的变化关系
B. ![]()
C. 溶液中水的电离程度:M>N
D. N点对应的溶液中c(Na+)>Q点对应的溶液中c(Na+)
【答案】B
【解析】
A.由“HA的酸性弱于HB的酸性”可知,Ka(HB)>Ka(HA),由图可知,曲线I表示溶液的pH与-lgc(B-)的变化关系,错误;B.根据图中M、N点的数据可知,c(A-)=c(B-),c(HA)=c(HB),故![]() ,正确;M点与N点存在c(A-)=c(B-),M点溶液的pH比N点溶液的pH小,故M点水的电离程度弱,错误;D.N、Q点对应溶液的pH相等,由图可知c(A-)<c(B-),根据电荷守恒可知,N点对应的溶液中c(Na+)小于Q点对应的溶液中c(Na+),错误。
,正确;M点与N点存在c(A-)=c(B-),M点溶液的pH比N点溶液的pH小,故M点水的电离程度弱,错误;D.N、Q点对应溶液的pH相等,由图可知c(A-)<c(B-),根据电荷守恒可知,N点对应的溶液中c(Na+)小于Q点对应的溶液中c(Na+),错误。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】向两份等体积、等浓度,pH不同的FeSO4溶液中逐滴加入NaClO溶液,实验测得溶液pH随加入NaClO溶液体积变化曲线如下图,实验现象如下表。下列说法不正确的是
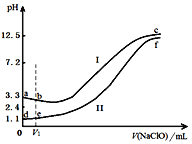
实验 | 实验现象 |
Ⅰ | 滴入V1mL NaClO溶液产生大量红褐色沉淀 |
Ⅱ | 滴入V1mL NaClO溶液,溶液变黄,未见沉淀,继续滴加出现红褐色沉淀 |
A. a~b段主要反应的离子方程式为:2Fe2+ + ClO-+5H2O===2Fe(OH)3↓+Cl-+4H+
B. d~e段主要反应的离子方程式为:2Fe2++2ClO-+3H+=== HClO + Cl-+ 2Fe3+ + H2O
C. c、f点pH接近的主要原因是:ClO-+ H2O![]() HClO + OH-
HClO + OH-
D. 向c点溶液中加入过量的浓盐酸,沉淀溶解并有刺激性气味的气体放出