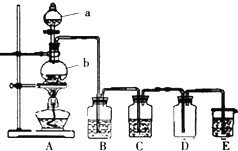
题目内容
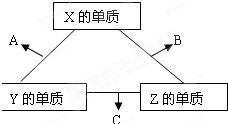
12.X、Y、Z三种短周期元素,它们的原子序数之和为16.X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如图所示变化:已知一个B分子中含有的Z元素的原子个数比C分子中的少一个.请回答下列问题:(1)X元素在周期表中的位置第二周期VIA族.
(2)X的单质与Z的单质可制成新型的化学电(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入氧气(填物质名称);负极电极反应式为H2+2OH--2e-=2H2O.
(3)C在一定条件下反应生成A的化学方程式是4NH3+5O2 催化剂_△4NO+6H2O.
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,属于放热反应.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应.下列说法中,正确的是ab(填写下列各项的序号).
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大.
分析 短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,A为NO,故X为氧,Y为氮,据此解答.
解答 解:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3,且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知A为NO,故X为氧,Y为氮.
(1)O元素的质子数为8,氧原子有2个电子层,最外层电子数为6,位于第二周期VIA族,
故答案为:第二周期VIA族;
(2)氢气、氧气、KOH溶液构成新型的化学电源,正极发生还原反应,氧气在正极通入,负极发生氧化反应,氢气在负极失去电子,碱性条件下生成水,负极电极反应式为:H2+2OH--2e-=2H2O,
故答案为:氧气;H2+2OH--2e-=2H2O;
(3)氨气发生催化氧化生成NO,反应方程式为:4NH3+5O2 催化剂_△4NO+6H2O
故答案为:4NH3+5O2 催化剂_△4NO+6H2O;
(4)氢气的单质与氮气的单质生成氨气的反应是可逆反应,△H<0.二者等物质的量混合,
N2(g)+3H2(g)?2NH3(g)
起始(mol):a a 0
转化(mol):x 3x 2x
某时刻(mol):a-x a-3x 2x
a.正反应速率与逆反应速率相等,可逆反应处于平衡状态,故a正确;
b.反应过程中氮气体积分数为a−x2a−2x=50%,故b正确;
c.氮气与氢气开始物质的量相等,二者按1:3反应,到达平衡时氮气与氢气的物质的量之比大于1:1,故c错误;
d.混合气体总质量不变,总的物质的量减小,达到化学平衡的过程中,混合气体平均相对分子质量增大,故d错误;
e.达到化学平衡后,再升高温度,平衡向逆反应方向移动,氨气的体积分数减小,故e错误,
故选:ab.
点评 本题考查无机物推断、原电池、化学平衡等,突破口为X、Y、Z三种短周期元素的单质为无色气体,再结合信息与转化关系推断,题目难度中等.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案| A. | 钙离子的结构示意图: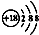 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4分子的球棍模型: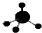 | D. | -CH3(甲基)的电子式为: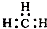 |
| 金属 | 冶炼原理 | |
| A | Fe | Fe2O3+3CO高温_ 2Fe+3CO2 |
| B | Hg | 2HgO △_ 2Hg+O2↑ |
| C | Al | 2AlCl3(熔融)通电_ 2Al+3Cl3↑ |
| D | Na | 2NaCl(熔融)通电_ 2Na+Cl2↑ |
| A. | A | B. | B | C. | C | D. | D |
| A. | H2和D2互为同位素 | |
| B. | 金刚石、石墨和“足球稀”C60为同素异形体 | |
| C. | 碳链为 与 与 的烃为同系物 的烃为同系物 | |
| D. |  和 和 互为同分异构体 互为同分异构体 |
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(2)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲(填“甲”或“乙”)判断正确.
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 12H2SO4(aq)+12Ba(OH)2(aq)═12BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中能量变化的大小与反应物的状态有关 | |
| C. | 化学变化中的能量变化全部是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |