题目内容
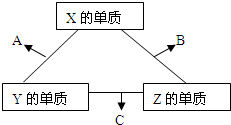
17.2014年8月3日16时30分在云南省昭通市鲁甸县(北纬27.1度,东经103.3度)发生6.5级地震,震源深度12千米,已致589人遇难.饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:| 阳离子 | K+、Na+、Cu2+、Al3+ |
| 阴离子 | SO42-、HCO3-、NO3-、OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃);
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象填写下列空白:
(1)写出化学式:ANaHCO3、BKNO3、CKAl(SO4)2、DCuSO4.
(2)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3.
(3)写出实验②发生反应的离子方程式Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O.
(4)C常用作净水剂,用离子方程式表示其净水原理Al3++3H2O=Al(OH)3(胶体)+3H+.
分析 ①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+离子,E中含有OH-离子;
③进行焰色反应实验,只有B、C为紫色,则B、C含有K+离子,结合离子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有HCO3-离子,C、D中产生白色沉淀,则C、D中含有SO42-离子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3.
解答 解:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液,则D中含有Cu2+离子;
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解,则C中含有Al3+离子,E中含有OH-离子;
③进行焰色反应实验,只有B、C为紫色,则B、C含有K+离子,结合离子共存,所以E是NaOH;
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,则A中含有HCO3-离子,C、D中产生白色沉淀,则C、D中含有SO42-离子,所以D是CuSO4,C是KAl(SO4)2,A是NaHCO3;
⑤将B、D两溶液混合,未见沉淀或气体生成,则B是KNO3.
(1)由上述分析可知,A为NaHCO3,B为KNO3,C为KAl(SO4)2,D为CuSO4,
故答案为:NaHCO3;KNO3;KAl(SO4)2;CuSO4;
(2)A是NaHCO3,E是NaOH,1mol A的溶液与含1mol E的溶液反应生成碳酸钠和水,蒸干过程中碳酸钠水解得到碳酸氢钠与氢氧化钠,最终二者又反应得到Na2CO3,
故答案为:Na2CO3 ;
(3)实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓、Al(OH)3+OH-═AlO2-+2H2O;
(4)C中含有铝离子,铝离子易水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水 中的悬浮物而净水,水解反应方程式为:Al3++3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3++3H2O=Al(OH)3(胶体)+3H+.
点评 本题考查无机物推断,属于未知物的检验推断,涉及离子共存、离子反应等,关键明确离子之间发生的反应现象,有利于培养学生的逻辑思维推理能力和,难度中等.

| A. | H2和D2互为同位素 | |
| B. | 金刚石、石墨和“足球稀”C60为同素异形体 | |
| C. | 碳链为 与 与 的烃为同系物 的烃为同系物 | |
| D. |  和 和 互为同分异构体 互为同分异构体 |
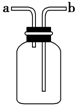
| A. | 洗气装置:瓶内放一定体积溶液,由a管口进气 | |
| B. | 收集不溶于水的气体:瓶内充满水,由b管口进气 | |
| C. | 排空气法收集氧气:由a管口进气 | |
| D. | 排空气法收集氢气:由a管口进气 |
| A. | 消去→加成→水解 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
已知:CO (g)+H2O (g)?H2 (g)+CO2 (g)平衡常数K随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(1)该反应的平衡常数表达式K=c(H2)•c(CO2)c(CO)•c(H20),△H=<0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2 (g)?2CO (g)平衡常数K1
C(s)+H2O (g)?H2 (g)+CO (g)平衡常数K2,
则K、K1、K2,之间的关系是K=K2K1
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为80%;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正=v逆 (填“>”、“=”或“<”).
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
Ⅱ(4)已知:KMnO4+H2C2O4+H2SO4→MnSO4+K2SO4+CO2↑+H20(未配平),向酸性KMnO4溶液中加入一定量的H2C2O4溶液,当溶液中的KMnO4耗尽后,紫色溶液将褪去.为确保能观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥2.5.
(5)为探究反应物浓度对化学反应速率的影响,该小组设计了如下实验方案
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中能量变化的大小与反应物的状态有关 | |
| C. | 化学变化中的能量变化全部是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
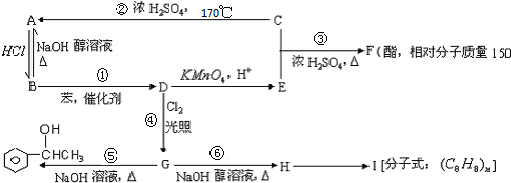



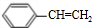
 .
.