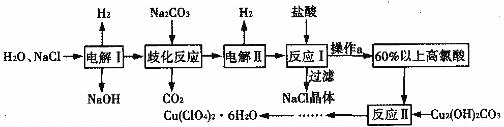
题目内容
【题目】NA为阿伏伽德罗常数的数值,下列说法中正确的是
①0.5mol O3与11.2L O2所含的分子数一定相等
②标准状况下,28g CO与N2的混合气体的体积约为22.4L
③通常状况下,NA个CO2分子占有的体积为22.4L
④常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
⑤常温下,4.4g的CO2和N2O(不反应)混合物中所含有的电子数为2.2NA
⑥标准状况下,22.4LH2O含有的分子数为NA
⑦在常温常压下,1molO2含有的原子数为2NA
A.①②③⑦B.②④⑤⑦C.①③⑤⑦D.②③④⑥
【答案】B
【解析】
①非标准状况下,11.2L O2的物质的量不一定是0.5mol,故①错误;
②CO与N2的摩尔质量都是28g/mol,28g CO与N2的混合气体的物质的量是1mol,标准状况下的体积约为22.4L,故②正确;
③NA个CO2分子的物质的量是1mol,标准状况下的体积是22.4L,故③错误;
④NO2和N2O4的最简式都是NO2,92g的NO2和N2O4混合气体含有的原子数![]() 6NA,故④正确;
6NA,故④正确;
⑤CO2和N2O分子中都有22个电子, CO2和N2O的摩尔质量都是44g/mol,4.4g的CO2和N2O(不反应)混合物中所含有的电子数为![]() 2.2NA,故⑤正确;
2.2NA,故⑤正确;
⑥标准状况下H2O是液体,22.4LH2O的物质的量不是1mol,故⑥错误;
⑦1个O2分子含有2个氧原子,1molO2含有的原子数为2NA,故⑦正确;
正确的是②④⑤⑦,选B。

【题目】在容积恒为0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5(mol·L-1)-2 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”、“=”或“<”)。
(2)下列各项能做为判断该反应达到化学平衡状态的依据的是_____(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于电解质的是_______________ ,属于非电解质的是____________________ 。
(2)过量②的水溶液与⑦反应的离子方程式 ________________________________。
(3)已知用金属钠制取氧化钠,可有多种方法:
①4Na + O2=2Na2O; ②4Na + CO2 =2Na2O + C;③2NaNO2 + 6Na =4Na2O + N2↑
在上述三种方法中,最好的是_________ ,原因是___________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞变红的原因 _______________________________;依据实验现象推测红色褪去的原因是___________________________________。
②加入MnO2反应的化学方程式为 ___________________________________ 。
(5)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:____________
(6)在化学课上老师向NaOH溶液通入CO2后无明显现象,那我们如何通过实验证明CO2与NaOH发生了反应?某化学小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化传感器测定溶液pH的变化,如图所示,请用化学方程式回答下列问题:
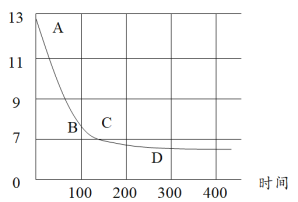
①BC段变化原因可能是 ___________________________________________________________ ;
②CD段变化原因可能是 ___________________________________________________________ 。