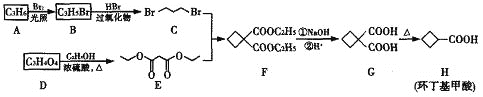
题目内容
【题目】六水合高氯酸铜[Cu(ClO4)2·6H2O]是一种易溶于水的蓝色晶体,常用作助燃剂。以食盐等为原料制备高氯酸铜晶体的一种工艺流程如下:
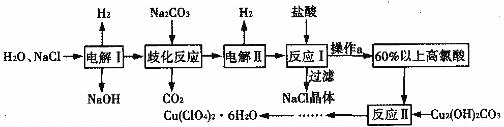
回答下列问题:
(1)Cu2(OH)2CO3在物质类别上属于__________(填序号)。
A.碱 B.盐 C.碱性氧化物
(2)发生“电解I”时所用的是__________(填“阳离子”或“阴离子”)交换膜。
(3)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。该反应的化学方程式为___________________。
(4)“电解II”的阳极产物为____________(填离子符号)。
(5)操作a的名称是______,该流程中可循环利用的物质是____________(填化学式)。
(6)“反应II”的离子方程式为___________________。
【答案】B 阳离子 3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2 ClO4- 蒸发浓缩 NaCl Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
【解析】
根据流程图,电解氯化钠溶液生成氢氧化钠、氢气和氯气,生成的氯气与碳酸钠发生歧化反应生成氯化钠和NaClO3,同时生成二氧化碳,电解生成的NaClO3生成高氯酸钠和氢气,用盐酸酸化,过滤除去氯化钠晶体,蒸发浓缩得到60%以上的高氯酸溶液,在高氯酸溶液中加入碱式碳酸铜反应生成高氯酸铜溶液,蒸发浓缩,冷却结晶得到高氯酸铜晶体,据此分析解答。
(1)Cu2(OH)2CO3中含有金属阳离子和酸根阴离子,属于盐,故答案为:B;
(2)“电解I”所发生的反应是电解氯化钠溶液生成氢氧化钠、氢气和氯气,需要防止氢氧根离子与氯气反应,所以用的交换膜是阳离子交换膜,故答案为:阳离子;
(3)“歧化反应”是氯气与碳酸钠反应生成氯化钠和NaClO3,氯元素从0价变为-1价和+5价,同时生成二氧化碳,反应的化学方程式为3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2,故答案为:3Na2CO3+3Cl2=5NaCl+NaClO3+3CO2;
(4)通过电解,溶液中氯酸根离子失电子发生氧化反应在阳极生成高氯酸根离子,“电解II”的阳极产物为ClO4-,故答案为:ClO4-;
(5)加入盐酸,过滤除去氯化钠晶体,滤液通过蒸发浓缩即可得到60%以上的高氯酸;从流程图可以看成,可循环利用的物质是NaCl,故答案为:蒸发浓缩;NaCl;
(6)“反应II”中高氯酸与碱式碳酸铜反应生成高氯酸铜,二氧化碳和水,碱式碳酸铜不溶于水,高氯酸为强酸,反应的离子方程式为Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O。

 考前必练系列答案
考前必练系列答案【题目】滴定实验是化学学科中重要的定量实验。
请回答下列问题:
(1)酸碱中和滴定——用标准盐酸滴定未知浓度的NaOH溶液,下列操作造成测定结果偏高的是 (填选项字母)
A.滴定终点读数时,俯视滴定管刻度,其他操作正确。
B.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
C.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗
D.滴定前,滴定管尖嘴有气泡,滴定后气泡消失
(2)氧化还原滴定——取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。表格中记录了实验数据:
滴定次数 | 待测液体积 | 标准KMnO4溶液体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 3.00 | 23.00 |
第三次 | 25.00 | 4.00 | 24.10 |
①滴定时,KMnO4溶液应装在 (填“酸”或“碱”)式滴定管中,滴定终点时滴定现象是
②该草酸溶液的物质的量浓度为_____________。
(3)沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4