题目内容
【题目】在容积恒为0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5(mol·L-1)-2 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”、“=”或“<”)。
(2)下列各项能做为判断该反应达到化学平衡状态的依据的是_____(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
【答案】(1)> (2)c (3)2 >
【解析】
(1)因反应是放热反应,升温平衡向左移动,反应程度减小,故K1>K2;(2)因反应前后气体总体积发生变化,故压强不变,说明反应混合物中各组分的含量不变,即反应处于平衡状态;反应前后气体质量不变,容器容积不变,故反应过程中混合气体的密度一直保持不变;反应平衡时,3v正(N2)=v逆(H2);容器中N2、H2、NH3的浓度之比与反应是否达到平衡状态无关;(3)在400℃时,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的化学平衡常数K=0.5,故400℃时,2NH3(g)
2NH3(g)的化学平衡常数K=0.5,故400℃时,2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数为
N2(g)+3H2(g)的化学平衡常数为![]() =2;利用容器中各物质的物质的量浓度可知:Q=
=2;利用容器中各物质的物质的量浓度可知:Q=![]() =
=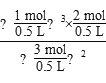 =
=![]() <2,所以反应2 NH3(g)
<2,所以反应2 NH3(g)![]() N2(g)+3H2(g)向右进行,v正(N2)>v逆(N2)
N2(g)+3H2(g)向右进行,v正(N2)>v逆(N2)

练习册系列答案
相关题目