题目内容
【题目】下表是生活生产中常见的物质,表中列出了它们的(主要)成分
编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
名称 | 酒精 | 醋酸 | 火碱 | 食盐 | 铜导线 | 亚硫酸酐 | 苏打 |
主要成分 | CH3CH2OH | CH3COOH | NaOH | NaCl | Cu | SO2 | Na2CO3 |
(1)请你对表中①~⑦的主要成分进行分类(填编号):
属于电解质的是_______________ ,属于非电解质的是____________________ 。
(2)过量②的水溶液与⑦反应的离子方程式 ________________________________。
(3)已知用金属钠制取氧化钠,可有多种方法:
①4Na + O2=2Na2O; ②4Na + CO2 =2Na2O + C;③2NaNO2 + 6Na =4Na2O + N2↑
在上述三种方法中,最好的是_________ ,原因是___________。
(4)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞变红的原因 _______________________________;依据实验现象推测红色褪去的原因是___________________________________。
②加入MnO2反应的化学方程式为 ___________________________________ 。
(5)在实验室模拟侯氏制碱法制备碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。该过程的化学方程式为:____________
(6)在化学课上老师向NaOH溶液通入CO2后无明显现象,那我们如何通过实验证明CO2与NaOH发生了反应?某化学小组同学将过量的干冰放入氢氧化钠溶液中,利用数字化传感器测定溶液pH的变化,如图所示,请用化学方程式回答下列问题:
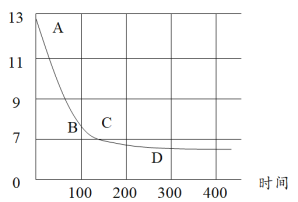
①BC段变化原因可能是 ___________________________________________________________ ;
②CD段变化原因可能是 ___________________________________________________________ 。
【答案】②③④⑦ ①⑥ 2CH3COOH + CO32- =2CH3COO- + H2O +CO2↑ ③ 生成的N2会保护Na2O不被氧化为Na2O2,生成物杂质少 2Na2O2 + 2H2O = 4NaOH +O2↑ 过氧化钠与水生成的过氧化氢氧化酚酞,使之褪色 2H2O2 ![]() 2H2O+O2↑ NaCl + NH3 + CO2 + H2O =NaHCO3↓ + NH4Cl 过量的二氧化碳与碳酸钠反应产生了碱性较弱的碳酸氢钠 二氧化碳与水反应产生了碳酸导致溶液pH小于7
2H2O+O2↑ NaCl + NH3 + CO2 + H2O =NaHCO3↓ + NH4Cl 过量的二氧化碳与碳酸钠反应产生了碱性较弱的碳酸氢钠 二氧化碳与水反应产生了碳酸导致溶液pH小于7
【解析】
(1)在水溶液或熔融状态下能导电的化合物是电解质;在水溶液或熔融状态下都不能导电的化合物是非电解质。
(2)过量醋酸与碳酸钠反应生成醋酸钠、二氧化碳、水。
(3)①Na与O2反应可能生成Na2O2; ②Na与CO2 反应的产物可能有Na2CO3;③N2能保护 Na2O 不被氧化;
(4)①Na2O2和水反应生成氢氧化钠和氧气;加入二氧化锰,有气泡产生,说明过氧化钠与水反应有过氧化氢生成;
②用二氧化锰作催化剂,过氧化氢分解为水和氧气;
(5)氯化钠、氨气、二氧化碳、水反应生成氯化铵和碳酸氢钠沉淀;
(6)向NaOH溶液通入CO2气体,依次发生反应CO2+2OH-=CO32-+H2O、CO2+CO32-+H2O=2HCO3-;
①酒精的水溶液不导电,熔融状态也不导电,酒精是非电解质;②醋酸水溶液能导电,醋酸是电解质;③氢氧化钠的水溶液能导电,氢氧化钠是电解质;④NaCl的水溶液能导电,氯化钠是电解质;⑤Cu是单质,既不是电解质又不是非电解质;⑥SO2不能发生自身电离,是非电解质;⑦Na2CO3的水溶液能导电,碳酸钠是电解质;所以属于电解质的是②③④⑦ 、属于非电解质的是①⑥;
(2)过量醋酸与碳酸钠反应生成醋酸钠、二氧化碳、水,反应的离子方程式是2CH3COOH + CO32- =2CH3COO- + H2O +CO2↑。
(3)Na与O2反应可能生成Na2O2; Na与CO2 反应的产物可能有Na2CO3; N2能保护 Na2O 不被氧化;反应③生成的N2会保护Na2O不被氧化为Na2O2,生成物杂质少,所以制备Na2O用③反应最好。
(4)①2Na2O2 + 2H2O = 4NaOH +O2↑,有氢氧化钠生成,所以滴入酚酞显红色;加入二氧化锰,有气泡产生,说明过氧化钠与水反应有过氧化氢生成,过氧化氢氧化酚酞,使之酚酞褪色;
②用二氧化锰作催化剂,过氧化氢分解为水和氧气,反应方程式是2H2O2 ![]() 2H2O+O2↑;
2H2O+O2↑;
(5)氯化钠、氨气、二氧化碳、水反应生成氯化铵和碳酸氢钠沉淀,反应方程式是NaCl + NH3 + CO2 + H2O =NaHCO3↓ + NH4Cl;
(6)向NaOH溶液通入CO2气体,依次发生反应CO2+2OH-=CO32-+H2O、CO2+CO32-+H2O=2HCO3-;①BC段溶液显弱碱性,所以变化原因可能是过量的二氧化碳与碳酸钠反应产生了碱性较弱的碳酸氢钠;
②CD段溶液显弱酸性,CD段变化原因可能是二氧化碳与水反应产生了碳酸导致溶液pH小于7。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】在容积恒为0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5(mol·L-1)-2 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”、“=”或“<”)。
(2)下列各项能做为判断该反应达到化学平衡状态的依据的是_____(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
已知:C(s)+2H2(g) = CH4(g) ΔH= -76 kJ·mol1
C(s)+O2(g) = CO2(g) ΔH= -394 kJ·mol1
2C(s)+ O2(g) =2 CO(g) ΔH= -222 kJ·mol1
该催化重整反应的ΔH=______kJ·mol1,有利于提高CH4平衡转化率的条件是(填标号)。______________
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应: CH4(g) | 消碳反应: CO2(g)+C(s) | ||
ΔH/(kJ·mol1) | +75 | +172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①上表判断,催化剂X_______Y(填“优于”或“劣于”),理由是:____________。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的 变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(υ)的叙述正确的是________填标号)。

A.K积、K消均增加
B.υ积减小,υ消增加
C.K积减小,K消增加
D.υ消增加的倍数比υ积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为υ=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为____。







