题目内容
12.如表列出了①~⑨九种元素在周期表中的位置:| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④在周期表中所处位置第二周期ⅥA族⑤、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是P3->S2->Na+.
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(3)元素⑦的原子结构示意图是
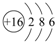 .
.(4)用电子式表示①与⑨反应得到的化合物的形成过程
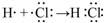 .
.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)④为O,位于周期表第2周期ⅥA族,离子的核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小;
(2)元素的非金属性越强,其氢化物的稳定性越强;
(3)元素⑦是S元素,硫原子核外有16个电子、3个电子层,据此书写硫的原子结构示意图;
(4))①和⑨两元素组成的化合物是HCl,为共价化合物.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为P、⑦为S、⑧为Ne、⑨为Cl.
(1)④为O,原子核外有2个电子层,最外层电子数为6,则位于周期表第2周期ⅥA族,⑤、⑥、⑦三种元素形成的离子分别为Na+、P3-、S2-,离子的核外电子层数越多,离子半径越大,核外电子排布相同的离子,核电荷数越大离子半径越小,则离子半径由大到小的顺序是P3->S2->Na+,
故答案为:第二周期ⅥA族;P3->S2->Na+;
(2)元素的非金属性越强,其氢化物的稳定性越强,元素非金属性P<S<O,所以氢化物的稳定性PH3<H2S<H2O,故答案为:PH3<H2S<H2O;
(3)元素⑦是S元素,硫原子核外有16个电子、3个电子层,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(4)①和⑨两元素组成的化合物是HCl,为共价化合物,用电子式表示①与⑨反应得到的化合物的形成过程为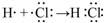 ,
,
故答案为: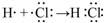 .
.
点评 本题考查元素周期表和元素周期律的综合应用,为高频考点,侧重考查元素周期表结构、元素周期律、物质性质的考查,熟练掌握元素周期律知识,知道非金属性强弱、金属性强弱判断方法,题目难度不大.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
2.下列物质熔沸点高低的比较,正确的是( )
| A. | HF>HI | B. | CCl4<CF4 | C. | SiO2<CO2 | D. | NaCl<KCl |
3.下列物质在一定条件下,不能和H2发生加成反应的是( )
| A. | CH3CH2CHO | B. | 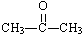 | C. | CH2=CHCOOH | D. | CH3COOCH3 |
20.下列说法正确的是( )
| A. | 淀粉、纤维素、油脂均属于高分子化合物 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| C. | 蛋白质水解的最终产物是多肽 | |
| D. | 石油的催化裂化主要是为了提高从石油得到的汽油等轻质油的产量 |
17.根据如图提供的信息,下列所得结论正确的是( )
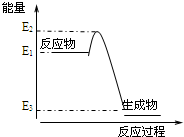

| A. | 该反应为吸热反应 | B. | 该反应向外界放出的热量为E1-E3 | ||
| C. | 该反应一定可以设计成为原电池 | D. | 该反应向外界放出的热量为E2-E3 |
 碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.