题目内容
10.为了减缓Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:A.H2O B.NaCl溶液 C.Na2CO3溶液 D.Cu粉 E.CuSO4粉末
你认为可行的是(填编号)AB.
分析 根据影响化学反应速率的因素以及氢气的量取决于H+的物质的量解答,应降低氢离子的浓度,且不影响氢离子总的物质的量.
解答 解:A、加入蒸馏水,溶液中H+的浓度减小,反应速率减小,H+的物质的量不变,氢气的量也不变,故A正确;
B、加入氯化钠溶液,减小盐酸的浓度,反应速率减小,H+的物质的量不变,氢气的量也不变,故B正确;
C、加入Na2CO3溶液,Na2CO3能与盐酸反应,H+的浓度减小,反应速率减小,H+的物质的量减小,氢气的量也减小,故C错误;
D、加入Cu粉,锌、铜、稀盐酸形成原电池,加快了化学反应速率,因Zn足量,则氢气的量不变,H+的物质的量不变,氢气的量也不变,故C错误;
E、加入CuSO4溶液,锌能置换出铜,锌、铜、稀盐酸形成原电池,加快了化学反应速率,因Zn足量,则氢气的量不变,故D错误;
故答案为:AB.
点评 本题主要考查化学反应速率的影响因素,难度不大,需要注意的是不减少产生氢气的量,注重基础知识的积累.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
20.下列说法正确的是( )
| A. | 淀粉、纤维素、油脂均属于高分子化合物 | |
| B. | 煤经过气化和液化等物理变化可转化为清洁燃料 | |
| C. | 蛋白质水解的最终产物是多肽 | |
| D. | 石油的催化裂化主要是为了提高从石油得到的汽油等轻质油的产量 |
18.NA 表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 12.5mL 16mol.L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 7.8g Na 2S和Na2O2 的混合物中含有的阴离子数等于0.1NA | |
| D. | 0.5mol氧单质含有NA个O2 |
 . 黄绿色固体:
. 黄绿色固体: .
.
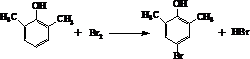 .
. .
.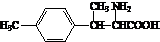 .
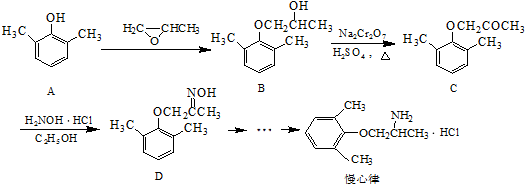
.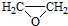 ).写出以邻甲基苯
).写出以邻甲基苯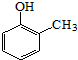 )和乙醇为原料制备
)和乙醇为原料制备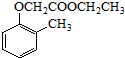 的合成路线流程图(无机试
的合成路线流程图(无机试