题目内容
【题目】铅具有优秀的机械加工性能,可以制备各种性能优良的合金。广泛用于电池制造、机械、船舶工业、以及放射性防护等领域。
(1)铅的主要矿藏形式是方铅矿(PbS)利用其冶炼铅的反应过程如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=akJ·mol-1
PbS(s)+2O2(g)=PbSO4(s) △H=bkJ·mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=ckJ·mol-1
则利用方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为____。
(2)铅也可以采用热还原法冶炼:PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
K | 106.2 | 631 | 17.4 |
①d____0(填>、<或=)
②已知某温度下K=10,向密闭容器中加入足量的Pb和一定量的CO2平衡时,混合气体中CO的体积分数为____。
(3)新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
下列关于该电池的说法正确的是____。
a.充放电时,溶液中Pb2+浓度保持不变
b.放电时,溶液中H+向PbO2极区移动
c.放电时的负极反应式为:Pb-2e-=Pb2+
d.充电时的阳极反应式为:Pb2++4OH--2e-=PbO2+2H2O
(4)河流、湖泊中的铅污染日益被人们重视。已知常温下Pb元素在水中的各种存在形式物质的量分数α和溶液pH的关系如图所示:
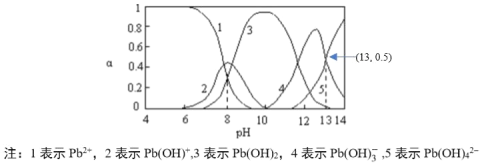
向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时的主要离子反应方程式是_____,其平衡常数数值为____。
【答案】PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H=![]() kJ·mol-1 < 9.09%或
kJ·mol-1 < 9.09%或![]() bc Pb(OH)3-+OH-=Pb(OH)42- 10
bc Pb(OH)3-+OH-=Pb(OH)42- 10
【解析】
⑴利用盖斯定律将第1个方程2倍加上第3个方程式2倍,减去第2个方程式的3倍,再同时除以3。
⑵①升高温度,平衡常数减小,平衡逆向移动,逆向是吸热反应,正向是放热反应;②根据平衡常数![]() ,计算混合气体中CO的体积分数。
,计算混合气体中CO的体积分数。
⑶a. 根据总反应得出放电时,溶液中Pb2+浓度增加,充电时,Pb2+浓度减少;b. 放电时,根据“同性相吸”得到溶液中H+向正极即PbO2极区移动;c. 根据总反应,放电时,Pb为负极,PbO2为正极,因此放电时的负极反应式为:Pb2e- = Pb2+;d. 充电时的阳极反应式为:Pb2++2H2O 2e- = PbO2 + 4H+。
⑷向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时,根据图中信息,主要是Pb(OH)3-与OH-反应生成Pb(OH)42,根据平衡常数公式进行计算。
⑴利用盖斯定律将第1个方程2倍加上第3个方程式2倍,减去第2个方程式的3倍,再同时除以3,则得到方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H =![]() kJ·mol1;故答案为:PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H =
kJ·mol1;故答案为:PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) △H =![]() kJ·mol1。
kJ·mol1。
⑵①升高温度,平衡常数减小,平衡逆向移动,逆向是吸热反应,正向是放热反应,因此d<0;故答案为:<。
②![]() ,则混合气体中CO的体积分数
,则混合气体中CO的体积分数![]() ;故答案为:9.09%或
;故答案为:9.09%或![]() 。
。
⑶新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O;a. 根据总反应得出放电时,溶液中Pb2+浓度增加,充电时,Pb2+浓度减少,故a错误;b. 放电时,根据“同性相吸”得到溶液中H+向正极即PbO2极区移动,故b正确;c. 根据总反应,放电时,Pb为负极,PbO2为正极,因此放电时的负极反应式为:Pb2e- = Pb2+,故c正确;d. 充电时的阳极反应式为:Pb2++2H2O 2e- = PbO2 + 4H+,故d错误;综上所述,答案为:bc。
2Pb2++2H2O;a. 根据总反应得出放电时,溶液中Pb2+浓度增加,充电时,Pb2+浓度减少,故a错误;b. 放电时,根据“同性相吸”得到溶液中H+向正极即PbO2极区移动,故b正确;c. 根据总反应,放电时,Pb为负极,PbO2为正极,因此放电时的负极反应式为:Pb2e- = Pb2+,故c正确;d. 充电时的阳极反应式为:Pb2++2H2O 2e- = PbO2 + 4H+,故d错误;综上所述,答案为:bc。
⑷向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时,根据图中信息,主要是Pb(OH)3-与OH-反应生成Pb(OH)42,其主要的离子反应方程式是Pb(OH)3-+OH-=Pb(OH)42,其平衡常数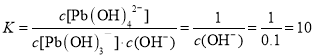 ;故答案为:Pb(OH)3-+OH-=Pb(OH)42;10。
;故答案为:Pb(OH)3-+OH-=Pb(OH)42;10。