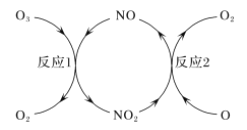
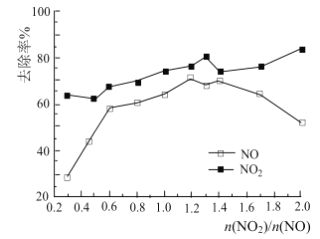
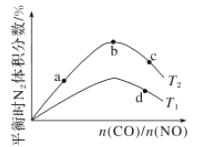
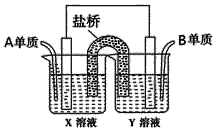
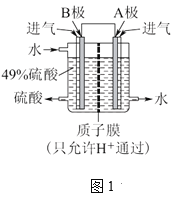
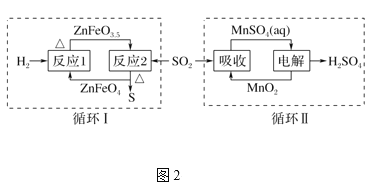
题目内容
【题目】(10分)碳元素在生产生活中具有非常重要的作用,在新物质的制备中也发挥了举足轻重的作用。
(1)与碳同周期,且基态原子的核外未成对电子数相等的元素是______(写出元素符号)。
(2)石墨烯是目前人们制造的新物质,该物质是由单层碳原子六边形平铺而成的,像一张纸一样(如图甲),石墨烯中碳原子的杂化方式为________;常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是___________________。

(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O形成的最小环上O原子数目是____________。
(4)图丙是C60的晶胞模型(一个小黑点代表一个C60分子),图中显示出的C60分子数为14个。实际上一个C60晶胞中含有________个C60分子。
【答案】(1)O (2)sp2 甲醇分子间存在氢键,而丙烯分子间只有范德华力 (3)6 (4)4
【解析】
试题(1)C原子核外未成对电子数是2,与碳同周期,说明处于第二周期,且基态原子的核外未成对电子数是2的元素是O元素。
(2)石墨烯中每个C原子价层电子对个数是3,根据价层电子对互斥理论知C原子杂化类型为sp2;相同温度下,含有分子间氢键的物质熔沸点较高,甲醇分子间形成氢键、丙烯分子间只存在范德华力,所以常温下甲醇是液态、丙烯是气态。
(3)金刚石中最小环上含有6个C原子,Si和金刚石结构相似,所以每个最小环上含有6个Si原子,二氧化硅晶体相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,所以Si、O形成的最小环上O原子数目是6。
(4)每个晶胞中C60分子个数=8×![]() +6×
+6×![]() =4。
=4。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】铅具有优秀的机械加工性能,可以制备各种性能优良的合金。广泛用于电池制造、机械、船舶工业、以及放射性防护等领域。
(1)铅的主要矿藏形式是方铅矿(PbS)利用其冶炼铅的反应过程如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=akJ·mol-1
PbS(s)+2O2(g)=PbSO4(s) △H=bkJ·mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=ckJ·mol-1
则利用方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为____。
(2)铅也可以采用热还原法冶炼:PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
K | 106.2 | 631 | 17.4 |
①d____0(填>、<或=)
②已知某温度下K=10,向密闭容器中加入足量的Pb和一定量的CO2平衡时,混合气体中CO的体积分数为____。
(3)新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
下列关于该电池的说法正确的是____。
a.充放电时,溶液中Pb2+浓度保持不变
b.放电时,溶液中H+向PbO2极区移动
c.放电时的负极反应式为:Pb-2e-=Pb2+
d.充电时的阳极反应式为:Pb2++4OH--2e-=PbO2+2H2O
(4)河流、湖泊中的铅污染日益被人们重视。已知常温下Pb元素在水中的各种存在形式物质的量分数α和溶液pH的关系如图所示:
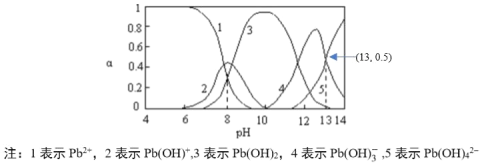
向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时的主要离子反应方程式是_____,其平衡常数数值为____。