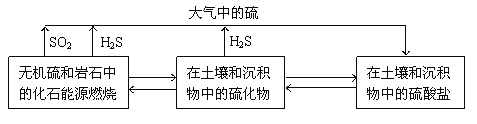
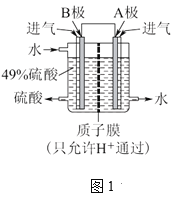
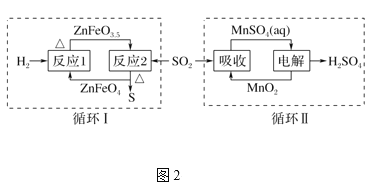
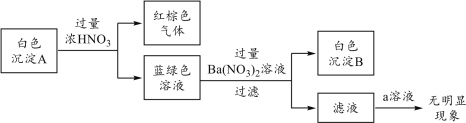题目内容
【题目】如图为高中化学教材《必修1》(人教版)中NaCl在水中的溶解和电离示意图。下列由此得出的说法中,错误的是
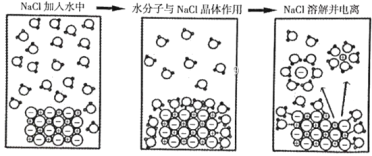
A.在H2O分子中,H或O原子均完全不带电荷
B.在NaCl晶体中,Na+和Cl-的排列整齐有序
C.Na+、Cl![]() 在水中是以水合离子的形式存在
在水中是以水合离子的形式存在
D.NaCl晶体的溶解和电离过程破坏了离子键
【答案】A
【解析】
A.在H2O分子中,O原子吸引电子的能力很强,O原子与H原子之间的共用电子对偏向于O,使得O原子相对显负电性,H原子相对显正电性,A项错误;
B.在NaCl晶体中,Na+和Cl-整齐有序地排列,B项正确;
C.Na+、Cl![]() 在水中是以水合离子的形式存在,C项正确;
在水中是以水合离子的形式存在,C项正确;
D.NaCl晶体的溶解和电离过程,使原本紧密结合的Na+与Cl-分开,成为了自由的水合离子,破坏了Na+与Cl-之间的离子键,D项正确;
答案选A。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案【题目】铅具有优秀的机械加工性能,可以制备各种性能优良的合金。广泛用于电池制造、机械、船舶工业、以及放射性防护等领域。
(1)铅的主要矿藏形式是方铅矿(PbS)利用其冶炼铅的反应过程如下:
2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) △H=akJ·mol-1
PbS(s)+2O2(g)=PbSO4(s) △H=bkJ·mol-1
PbS(s)+2PbO(s)=3Pb(s)+SO2(g) △H=ckJ·mol-1
则利用方铅矿和铅矾矿(主要成分为PbSO4)冶炼铅并生产一种可能造成酸雨的气体的热化学方程式为____。
(2)铅也可以采用热还原法冶炼:PbO(s)+CO(g)![]() Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
Pb(s)+CO2(g) △H=dkJ·mol-1,已知该反应的平衡常数和温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
K | 106.2 | 631 | 17.4 |
①d____0(填>、<或=)
②已知某温度下K=10,向密闭容器中加入足量的Pb和一定量的CO2平衡时,混合气体中CO的体积分数为____。
(3)新型液流式铅蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+![]() 2Pb2++2H2O
2Pb2++2H2O
下列关于该电池的说法正确的是____。
a.充放电时,溶液中Pb2+浓度保持不变
b.放电时,溶液中H+向PbO2极区移动
c.放电时的负极反应式为:Pb-2e-=Pb2+
d.充电时的阳极反应式为:Pb2++4OH--2e-=PbO2+2H2O
(4)河流、湖泊中的铅污染日益被人们重视。已知常温下Pb元素在水中的各种存在形式物质的量分数α和溶液pH的关系如图所示:
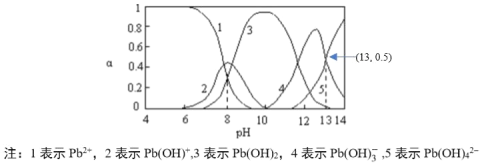
向醋酸铅溶液中逐滴滴加氢氧化钠溶液至pH=13时的主要离子反应方程式是_____,其平衡常数数值为____。
【题目】碘酸钾(![]() )是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中
)是重要的微量元素碘添加剂。实验室设计下列实验流程制取并测定产品中![]() 的纯度:
的纯度:
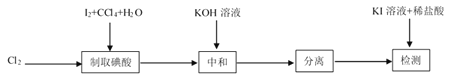
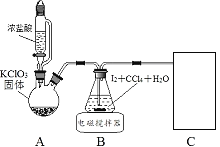
其中制取碘酸(![]() )的实验装置见图,有关物质的性质列于表中
)的实验装置见图,有关物质的性质列于表中
物质 | 性质 |
HIO3 | 白色固体,能溶于水,难溶于CCl4 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生氧化反应:ClO-+IO3-=IO4-+Cl- |
回答下列问题
(1)装置A中参加反应的盐酸所表现的化学性质为______________。
(2)装置B中反应的化学方程式为___________________ 。B中所加CCl4的作用是_________从而加快反应速率。
(3)分离出B中制得的![]() 水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低
水溶液的操作为____________;中和之前,需将HIO3溶液煮沸至接近于无色,其目的是____________,避免降低![]() 的产率。
的产率。
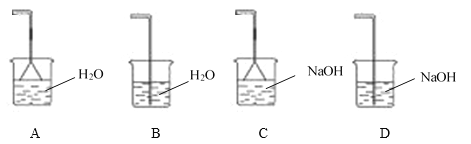
(4)为充分吸收尾气,保护环境,C处应选用最合适的实验装置是____________(填序号)。
(5)为促使![]() 晶体析出,应往中和所得的
晶体析出,应往中和所得的![]() 溶液中加入适量的___________。
溶液中加入适量的___________。
(6)取1.000g![]() 产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L
产品配成200.00mL溶液,每次精确量取20.00mL溶液置于锥形瓶中,加入足量KI溶液和稀盐酸,加入淀粉作指示剂,用0.1004mol/L![]() 溶液滴定。滴定至终点时蓝色消失(
溶液滴定。滴定至终点时蓝色消失(![]() ),测得每次平均消耗
),测得每次平均消耗![]() 溶液25.00mL。则产品中
溶液25.00mL。则产品中![]() 的质量分数为___(结果保留三位有效数字)。
的质量分数为___(结果保留三位有效数字)。