题目内容
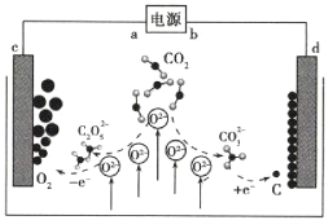
【题目】《Journal of Energy Chemistry》报道我国科学家设计![]() 熔盐捕获与转化装置如图。下列有关说法正确的是( )
熔盐捕获与转化装置如图。下列有关说法正确的是( )
A.![]() 为负极
为负极
B.熔盐可用![]() 溶液代替
溶液代替
C.转移![]() 电子可捕获
电子可捕获![]() (标准状况下)
(标准状况下)
D.![]() 的电极反应式为
的电极反应式为![]()
【答案】D
【解析】
根据装置图可知,熔盐捕获CO2生成的C2O![]() 在c极发生氧化反应生成单质O2,所以c为阳极,相应的反应为2CO2+O2-= C2O
在c极发生氧化反应生成单质O2,所以c为阳极,相应的反应为2CO2+O2-= C2O![]() 、2 C2O
、2 C2O![]() -4e-=4CO2+O2;熔盐捕获CO2生成的CO32-在d极发生得电子的还原反应生成C,d为阴极,相应的反应为CO2+O2-= CO
-4e-=4CO2+O2;熔盐捕获CO2生成的CO32-在d极发生得电子的还原反应生成C,d为阴极,相应的反应为CO2+O2-= CO![]() 、CO
、CO![]() +4e-=C+3O2-;总反应为CO2
+4e-=C+3O2-;总反应为CO2![]() C+O2,熔盐在电解前后不变,可连续使用;阳极与电源正极相接、阴极与电源负极相接,即a极为电源正极、b极为电源负极。
C+O2,熔盐在电解前后不变,可连续使用;阳极与电源正极相接、阴极与电源负极相接,即a极为电源正极、b极为电源负极。
A.c极电极反应是2C2O![]() -4e-═4CO2+O2,发生氧化反应,是电解池的阳极,则a为正极,故A错误;
-4e-═4CO2+O2,发生氧化反应,是电解池的阳极,则a为正极,故A错误;
B.如果用氢氧化钾溶液代替熔盐,KOH溶液捕获二氧化碳生成K2CO3或KHCO3,c极是氢氧根离子放电,d极是氢离子放电,本质上电解水,KOH被消耗完后不能捕获更多的CO2,不能连续使用,所以熔盐不可用KOH溶液代替,故B错误;
C.由总反应为CO2![]() C+O2可知,转移4mol的电子捕获1mol二氧化碳,转移lmol电子可捕获CO25.6L(标况下),故C错误;
C+O2可知,转移4mol的电子捕获1mol二氧化碳,转移lmol电子可捕获CO25.6L(标况下),故C错误;
D.d极是电解池的阴极,发生还原反应生成单质碳,电极反应式为:CO![]() +4e-=C+3O2-,故D正确;
+4e-=C+3O2-,故D正确;
故选D。

【题目】(1)反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
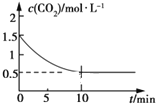
①该条件下反应的平衡常数为___;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为___mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填序号)。
增大的是___(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)