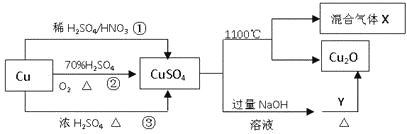
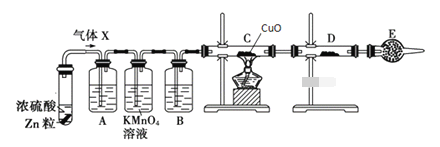
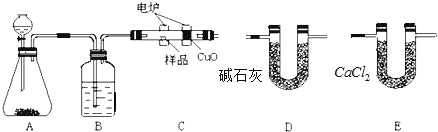
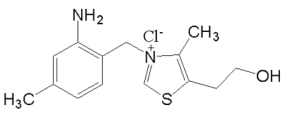
题目内容
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/ mol·L-1 | V mL | c/ mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出___(填外部因素)的改变对化学反应速率的影响。
(2)其中V1=___、T1=__;通过实验___(填实验序号)可探究出温度变化对化学反应速率的影响,其中V2=___。
(3)若t1<8,则由此实验可以得出的结论是___;
(4)忽略溶液体积的变化,利用实验B中数据计算,0~8s内,用KMnO4的浓度变化表示的反应速率v(KMnO4)=___。
【答案】浓度 1 293 B、C 3 其他条件相同时,增大反应物浓度,反应速率增大 8.3×10-4mol·L-1·s-1
【解析】
根据表格数据,A、B应控制温度相同,探究浓度对反应速率的影响,B、C的温度不同,可探究温度对反应速率的影响,研究某种因素对反应速率的影响时,需要保证其余条件相同,结合v=![]() 分析解答。
分析解答。
(1)实验A、B,使用的H2C2O4溶液的体积不等,故实验A、B可探究出H2C2O4浓度的改变对反应速率的影响,故答案为:浓度;
(2)实验A、B可探究出H2C2O4浓度的改变对反应速率的影响,需要保证其余条件相同,根据实验A可知,保证溶液的总体积为6mL,B中H2C2O4溶液3mL,故需加水6mL-2mL-3mL=1mL;需要温度也相同,故T1=293;实验B、C的温度不同,要探究出温度变化对化学反应速率的影响,其余条件需要相同,则V2=6mL-2mL-1mL=3mL,故答案为:1;293;BC;3;
(3)若t1<8,由此实验可以得出的结论是:其他条件相同时,增大反应物浓度,反应速率增大,故答案为:其他条件相同时,增大反应物浓度,反应速率增大;
(4)根据实验B中数据可知,高锰酸钾完全反应需要的时间为8s,高锰酸钾的物质的量为0.02molL-1×0.002L=0.00004mol,混合后溶液中高锰酸钾的浓度为![]() =
=![]() ×10-2mol/L,则用KMnO4的浓度变化表示的反应速率为
×10-2mol/L,则用KMnO4的浓度变化表示的反应速率为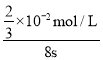 =8.3×10-4mol/(Ls),故答案为:8.3×10-4mol/(Ls)。
=8.3×10-4mol/(Ls),故答案为:8.3×10-4mol/(Ls)。

 阅读快车系列答案
阅读快车系列答案【题目】(1)反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g),平衡常数为K1;反应Fe(s)+H2O(g) ![]() FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
FeO(s)+H2(g),平衡常数为K2。在不同温度时K1、K2的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
反应CO2(g)+H2(g) ![]() CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g),平衡常数K,则K=___(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g) ![]() CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是___反应(填“吸热”或“放热”)。
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应Fe(s)+CO2(g) ![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示:
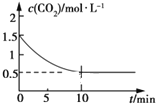
①该条件下反应的平衡常数为___;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为___mol·L-1。
②下列措施中能使平衡时![]() 增大的是___(填序号)。
增大的是___(填序号)。
A.升高温度 B.增大压强
C.再充入一定量的CO2 D.再加入一定量铁粉
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)