题目内容
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活有着重要意义。
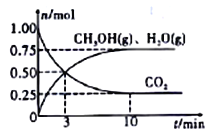
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。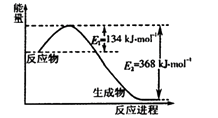
(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=kJ·mol-1。
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2 , 在一定条件下发生如下反应。N2(g)+3H2(g) ![]() 2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) ![]() 2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
T/K | 298 | 398 | 498 |
平衡常数K | 51 | K1 | K2 |
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
【答案】
(1)NO2(g)+CO(g)= CO2(g)+NO(g) △H = -234 kJ·mol-1
(2)-283
(3)0.01 molL-1min-1;50%;59.3
(4)>
(5)b c
【解析】(1)该反应的焓变△H=E1-E2=134KJ/mol-368KJ/mol=-234KJ/mol,所以热化学方程式为:NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJmol-1;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+180kJmol-1②2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJmol-1 , 利用盖斯定律将①× ![]() +②×
+②× ![]() 可得CO(g)+
可得CO(g)+ ![]() O2(g)=CO2(g)△H=
O2(g)=CO2(g)△H= ![]() ×[+180kJmol-1+(-746kJmol-1)]=-283Jmol-1;
×[+180kJmol-1+(-746kJmol-1)]=-283Jmol-1;
(3)
N2(g)+ | 3H2(g) | 2NH3(g) | |
起始(mol/L) | 0.1 | 0.3 | 0 |
转化(mol/L) | 0.05 | 0.15 | 0.1 |
平衡(mol/L) | 0.05 | 0.15 | 0.1 |
第5分钟时达到平衡,测得NH3的物质的量为0.2mol,所以减小的氮气物质的量为0.1mol,v(N2)= ![]() =
= ![]() =0.01mol/(Lmin),平衡时H2的转化率为
=0.01mol/(Lmin),平衡时H2的转化率为 ![]() ×100%=50%,该反应的平衡常数K=
×100%=50%,该反应的平衡常数K= ![]() =59.3;
=59.3;
(4)反应为放热反应,生成温度平衡向逆反应方向移动,平衡常数减小,则K1>K2;
(5)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,a不符合题意;
b.NH3的浓度保持不变,可说明达到平衡状态,b符合题意;
c.容器内压强保持不变,可说明达到平衡状态,c符合题意;
d.因体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,d不符合题意;
所以答案是:(1)NO2(g)+CO(g)═NO(g)+CO2(g)△H=-234kJmol-1;(2)-283;(3)0.01 mol/(Lmin);50%;59.3;(4)>;(5)bc
【考点精析】关于本题考查的反应速率的定量表示方法和化学平衡状态的判断,需要了解反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能得出正确答案.

【题目】
(1)I.已知:Na2S2O3 + H2 SO4=Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
①该实验①、②可探究温度对反应速率的影响,因此V1= , V2 = , V3=;
(2)②若V4=10.0,V5=6.0,则实验①、③可探究 对反应速率的影响。
(3)Ⅱ.利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
①滴定应选择的指示剂是 , 滴定终点的现象为。
②对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,要用对应装入的溶液润洗滴定管和锥形瓶
B.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
C.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度的表达式为。