题目内容
【题目】
(1)I.已知:Na2S2O3 + H2 SO4=Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
①该实验①、②可探究温度对反应速率的影响,因此V1= , V2 = , V3=;
(2)②若V4=10.0,V5=6.0,则实验①、③可探究 对反应速率的影响。
(3)Ⅱ.利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
①滴定应选择的指示剂是 , 滴定终点的现象为。
②对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,要用对应装入的溶液润洗滴定管和锥形瓶
B.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
C.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度的表达式为。
【答案】
(1)10.0;10.0;0
(2)浓度
(3)淀粉;溶液刚好出现蓝色,且半分钟不褪去;BD;![]() ×100%
×100%
【解析】I.①实验①、②的温度不同,故可探究温度对反应速率的影响;而要探究温度对反应速率的影响,则必须保持其他影响因素一致:即加入的Na2S2O3溶液的量相同,故V1=10.0mL,加入的硫酸的量相同,故V2=10.0mL,加入水的体积相等,故V3=0;
②实验①、③加入的Na2S2O3溶液的量相同,故V4=10.0mL,溶液总体积也须相同,故加入的水的体积V5=6.0mL,加入的硫酸的量不同,故可探究浓度对反应速率的影响;
Ⅱ.①淀粉遇到单质碘变蓝色,滴定前可以选择淀粉做指示剂,滴定终点的现象为溶液刚好出现蓝色,且半分钟不褪去;
②A、滴定前,对锥形瓶进行润洗,待测液的物质的量偏大,造成V(标准)偏大,根据c(待测)= ![]() 分析,c(待测)偏高;
分析,c(待测)偏高;
B、滴定过程中,标准液滴到锥形瓶外,造成V(标准)偏大,根据c(待测)= ![]() 分析,c(待测)偏高;
分析,c(待测)偏高;
C、滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,造成V(标准)偏大,根据c(待测)= ![]() 分析,c(待测)偏高,待测液的物质的量偏大,则所测得的纯度将会偏大;
分析,c(待测)偏高,待测液的物质的量偏大,则所测得的纯度将会偏大;
D、滴定前仰视读数而滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)= ![]() 分析,
分析,
c(待测)偏低,待测液的物质的量偏低,则所测得的纯度将会偏小;
③根据I2+2Na2S2O3=Na2S4O6+2NaI,n(I2)=amol/L×b×10-3L,知消耗的Na2S2O3的物质的量=2n(I2)=2amol/L×b×10-3L,根据现称取Wg硫代硫酸钠固体样品配成250mL的溶液,取25.00mL置于锥形瓶中,则被滴定的硫代硫酸钠质量为 ![]() Wg,故样品中硫代硫酸钠纯度的表达式为
Wg,故样品中硫代硫酸钠纯度的表达式为 ![]() ×100%=
×100%= ![]() ×100%;
×100%;
故答案为:I.①10.0;0;②浓度;Ⅱ.①淀粉;溶液刚好出现蓝色,且半分钟不褪去;②BD;③![]() 本题是对化学反应速率、中和滴定、化学计算的综合考查。对此类综合度较高的试题的解答,应充分结合所学知识进行分析。滴定过程中,滴定终点的判断,应体现半分钟内不褪色。
本题是对化学反应速率、中和滴定、化学计算的综合考查。对此类综合度较高的试题的解答,应充分结合所学知识进行分析。滴定过程中,滴定终点的判断,应体现半分钟内不褪色。

【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。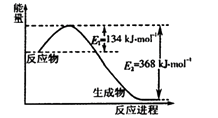
(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=kJ·mol-1。
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2 , 在一定条件下发生如下反应。N2(g)+3H2(g) ![]() 2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) ![]() 2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
T/K | 298 | 398 | 498 |
平衡常数K | 51 | K1 | K2 |
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变
【题目】某化学研究性学习小组针对原电池形成条件,设计了实验方案,进行如下探究。
(1)请填写有关实验现象并得出相关结论。
编号 | 实验装置 | 实验现象 |
1 |
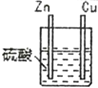
| 锌棒逐渐溶解,表面有气体生成;铜棒表面无现象 |
2 |
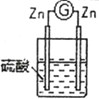
| 两锌棒逐渐溶解,表面均有气体生成;电流计指针不偏转 |
3 |
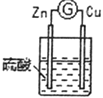
| 铜棒表面的现象是______________________,电流计指针___________________ |
①通过实验2和3,可得出原电池的形成条件是______________________________。
②通过实验1和3,可得出原电池的形成条件是______________________________。
③若将3装置中硫酸换成乙醇,电流计指针将不发生偏转,从而可得出原电池形成条件是___________________。
(2)分别写出实验3中Zn棒和Cu棒上发生的电极反应式:
Zn棒:______________________________。
Cu棒:______________________________。
(3)实验3的电流是从________棒流出(填“Zn”或“Cu”),反应过程中若有0.4mol电子发生了转移,则Zn电极质量减轻___________g。