题目内容
【题目】某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g) ![]() C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则( )
A.a=3
B.a=2
C.B的转化率为40%
D.B的转化率为60%
【答案】C
【解析】容器的体积扩大为原来的10倍,A的转化率不发生变化,说明平衡不移动,即反应前后体积不变,所以a=1,AB都不正确。根据反应式可知
A(g)+ | B(g) | C(g)+ | D(g) | |
起始(mol) | 2 | 3 | 0 | 0 |
转化(mol) | x | x | x | x |
平衡(mol) | 2-x | 3-x | x | x |
所以有 ![]() ,解得x=1.2,所以B的转化率是
,解得x=1.2,所以B的转化率是 ![]()
故答案为:C
由压强改变,平衡不移动,得出a=1;列出平衡三段式,结合平衡常数![]() 计算平衡时各物质的物质的量,再根据转化率公式计算B的转化率。
计算平衡时各物质的物质的量,再根据转化率公式计算B的转化率。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案【题目】下列实验操作和对应的离子方程式都正确的是( )
选项 | 实验操作 | 离子方程式 |
A | 向溴化亚铁溶液中滴加氯水,证明还原性:Fe2+>Br- | Cl2+2Br-=Br2+2Cl- |
B | 用澄清石灰水鉴别K2SO3溶液和KHSO3溶液 | Ca2++SO32-=CaSO3↓ |
C | 用饱和Na2CO3溶液浸泡试管中的硫酸钙 | CaSO4+CO32- |
D | 向Al2(SO4)3溶液中滴加氨水制备氢氧化铝 | Al3++3OH-=Al(OH)3↓ |
A. A B. B C. C D. D
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式。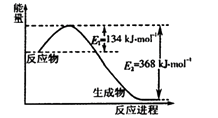
(2)已知:
N2(g)+O2(g)=2 NO(g) △H=+180 kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H=kJ·mol-1。
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2 , 在一定条件下发生如下反应。N2(g)+3H2(g) ![]() 2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
2NH3(g)△H<0,若第5min时达到平衡,此时测得NH3的物质的量为0.2mol,则前5min的平均反应速率v(N2)为 , 平衡时H2的转化率为 , 该反应的平衡常数K=(计算结果保留一位小数)。
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g) ![]() 2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
2NH3(g) △H <0的平衡常数K与温度T的关系如下表:则K1K2(填写“>”、“=”或“<”)
T/K | 298 | 398 | 498 |
平衡常数K | 51 | K1 | K2 |
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.NH3的浓度保持不变
c.容器内压强保持不变
d.混合气体的密度保持不变