题目内容
【题目】CuSO4 5H2O是铜的重要化合物,有着广泛的应用。
(一)CuSO4·5H2O制取
完成下列填空:
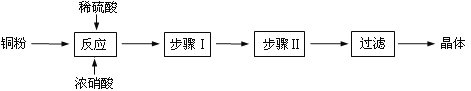
(1)向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),铜粉溶解时可以观察到的实验现象:_____。
(2)根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为______________________。
(3)步骤Ⅰ______________;步骤Ⅱ______________。
(二)胆矾中CuSO4·5H2O含量的测定
已知:CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
(1)实验方案如下,并将步骤④补全:
①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应);
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸;
④___________________________
⑤数据处理。
(2)在滴定中,眼睛应注视__________;滴定终点时,准确读数应该是滴定管上________所对应的刻度。
(3)就方案中数据进行处理,则样品CuSO4·5H2O中质量分数为___________。步骤③中沉淀未洗涤,导致结果______(填偏大、偏小、无影响)。
【答案】无色气体变为红棕色气体,溶液呈蓝色 2:3 蒸发浓缩 冷却结晶 做平行实验1~2次 锥形瓶中溶液颜色变化 蓝线粗细交接点 0.8 偏大
【解析】
(一)CuSO45H2O制取,Cu和稀硫酸不反应,加入浓硝酸后,二者反应生成铜离子、NO,加入足量稀硫酸,使硝酸完全转化为NO,然后过滤得到硫酸铜溶液,蒸发浓缩、冷却结晶,然后过滤得到CuSO45H2O晶体;
(二)(4)①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中,目的是配制一定物质的量浓度溶液;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应),二者反应方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸,盐酸消耗多余的HCl,反应方程式为HCl+NaOH=NaCl+H2O;
④做平行实验减小实验误差;
⑤数据处理.
(5)在滴定中,眼睛应注视锥形瓶内溶液颜色变化;滴定终点时,准确读数应该是滴定管上蓝线粗细交接点所对应的刻度;
(6)n(NaOH)=0.2500mol/L×0.1L=0.025mol,n(HCl)=0.5000mol/L×0.010L=0.005mol,根据HCl+NaOH=NaCl+H2O知,盐酸消耗n(NaOH)=n(HCl)=0.005mol,所以与硫酸铜反应n(NaOH)=0.025mol-0.005mol=0.02mol,根据得CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,n(CuSO4)=![]() n(NaOH)=
n(NaOH)=![]() ×0.02mol=0.01mol,100mL中硫酸铜的物质的量=0.01mol×4=0.04mol,结合Cu原子守恒,根据质量分数公式计算其质量分数;步骤③中沉淀未洗涤,导致沉淀质量增大,所以测定结果偏大。
×0.02mol=0.01mol,100mL中硫酸铜的物质的量=0.01mol×4=0.04mol,结合Cu原子守恒,根据质量分数公式计算其质量分数;步骤③中沉淀未洗涤,导致沉淀质量增大,所以测定结果偏大。
(一) (1)Cu和稀硫酸不反应,加入浓硝酸后,二者反应生成铜离子、NO,NO不稳定及易被氧化生成红棕色二氧化氮气体,所以看到的现象是无色气体变为红棕色气体,溶液呈蓝色;
(2)离子反应方程式为3Cu+2NO3+8H+=3Cu2++2NO↑+4H2O,假设有2mol硝酸反应,硝酸提供2mol氢离子,还有6mol氢离子被3mol硫酸提供,所以根据反应原理,硝酸与硫酸的理论配比2:3;
(3)通过以上分析知,步骤I为蒸发浓缩、步骤II为冷却结晶;
(二)(4)①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中,目的是配制一定物质的量浓度溶液;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应),二者反应方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸,盐酸消耗多余的HCl,反应方程式为HCl+NaOH=NaCl+H2O;
④做平行实验减小实验误差;
⑤数据处理,
通过以上分析知,该操作是作平行实验12次;
(5)在滴定中,眼睛应注视锥形瓶内溶液颜色变化;滴定终点时,准确读数应该是滴定管上蓝线粗细交接点所对应的刻度;
(6)n(NaOH)=0.2500mol/L×0.1L=0.025mol,n(HCl)=0.5000mol/L×0.010L=0.005mol,根据HCl+NaOH=NaCl+H2O知,盐酸消耗n(NaOH)=n(HCl)=0.005mol,所以与硫酸铜反应n(NaOH)=0.025mol0.005mol=0.02mol,根据得CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,n(CuSO4)=![]() n(NaOH)=
n(NaOH)=![]() ×0.02mol=0.01mol,100mL中硫酸铜的物质的量=0.01mol×4=0.04mol,结合Cu原子守恒得m(CuSO45H2O)=n(CuSO45H2O) M(CuSO45H2O)=n(CuSO4)M(CuSO45H2O)=0.04mol×250g/mol=10.000g,其质量分数=
×0.02mol=0.01mol,100mL中硫酸铜的物质的量=0.01mol×4=0.04mol,结合Cu原子守恒得m(CuSO45H2O)=n(CuSO45H2O) M(CuSO45H2O)=n(CuSO4)M(CuSO45H2O)=0.04mol×250g/mol=10.000g,其质量分数=![]() ×100%=80%;步骤③中沉淀未洗涤,导致沉淀质量增大,所以测定结果偏大。
×100%=80%;步骤③中沉淀未洗涤,导致沉淀质量增大,所以测定结果偏大。

 阅读快车系列答案
阅读快车系列答案