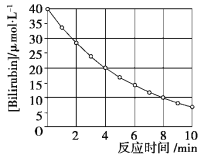
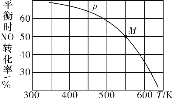
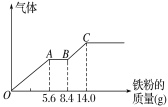
题目内容
【题目】已知![]() 的相对原子质量为34.969,下列相关说法正确的是( )
的相对原子质量为34.969,下列相关说法正确的是( )
A.氯元素的近似相对原子质量为35
B.氯元素的某种同位素的质量数为35
C.氯元素的中子数为18
D.氯原子的质量为34.969
【答案】B
【解析】
元素的相对原子质量为该元素各种核素的相对原子质量的平均值,原子的近似相对原子质量在数值上等于其质量数。
A. 该氯原子的近似相对原子质量为35,而氯元素各核素的相对原子质量的平均值,并不一定等于35,A错误;
B. ![]() 即是氯元素中一种核素,质量数为35,B正确;
即是氯元素中一种核素,质量数为35,B正确;
C. 元素的中子数=质量数-质子数,![]() 的质量数为35,质子数为17,即中子数为18,但氯元素有多种同位素,中子数不能直接确定,C错误;
的质量数为35,质子数为17,即中子数为18,但氯元素有多种同位素,中子数不能直接确定,C错误;
D. 原子的相对原子质量是该原子与0.012kg12C质量的比例,氯原子的实际质量不是34.969,D错误。
答案为B。

【题目】下表为元素周期表的短周期部分。
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有 _____ 种不同伸展方向的电子云,最外层共有 _____ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)_______>__________;b、c 两元素非金属性较强的是(写元素符号)________,写出证明这一结论的一个化学方程式 ___________________ 。
(3)d、e元素形成的四原子化合物的电子式为___________;b、g元素形成的分子bg2为__________分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd 4)2和盐S:ca4agd4 ,相同条件下,0.1 mol/L 盐R中c(ca4+)________(填“等于”、“大于”或“小于”)0.1 mol/L 盐S中c(ca4+)。
(5)向盛有10mL1 mol/L盐S溶液的烧杯中滴加1 mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是 __________________________________________ 。
(6)向盛有10mL 1 mol/L盐 R溶液的烧杯中滴加1 mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL—35mL)间发生的离子方程式: _________________________ 。若在10mL 1 mol/L 盐R溶液的烧杯中加20mL1.2 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。