题目内容
17.将硫化氢通入不同浓度的硝酸溶液中,发生下列反应:①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
结合所学有关硝酸的知识,判断硝酸浓度由大到小的顺序正确的是( )
| A. | ①>②>③>④ | B. | ②>①>④>③ | C. | ②>①>③>④ | D. | ④>③>①>② |
分析 由基础知识可知:Cu与浓硝酸反应生成NO2气体,与稀硝酸反应生成NO气体,由此可知硝酸浓度越大,反应后N元素被还原生成的价态越高,硝酸的氧化性越强.所以结合反应后N元素的化合价可知,浓度由大到小的顺序应该是B项.
解答 解:将硫化氢通入不同浓度的硝酸溶液中,发生下列反应:
①3H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$3S↓+2NO↑+4H2O
②H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$S↓+2NO2↑+2H2O
③4H2S+2HNO3$\frac{\underline{\;冷\;}}{\;}$4S↓+NH4NO3+3H2O
④5H2S+2HNO3═5S↓+N2↑+6H2O
Cu与浓硝酸反应生成NO2气体,与稀硝酸反应生成NO气体,由此可知硝酸浓度越大,反应后N元素被还原生成的价态越高,硝酸的氧化性越强.所以结合反应后N元素的化合价可知,浓度由大到小的顺序应该是B项,
故选B.
点评 本题考查了浓度大小对硝酸氧化性的影响,考查学生的信息迁移能力,知识思维的连续性,题目难度中等.

练习册系列答案
相关题目
7.对于 90℃的纯水,以下认识正确的是( )
| A. | c (H+)>10-7 mol/L>c (OH-) pH<7 显中性 | |
| B. | c (H+)=c (OH-)>10-7 mol/L pH<7 显中性 | |
| C. | c (H+)>10-7 mol/L>c (OH-) pH<7 显酸性 | |
| D. | c (H+)=c (OH-)>10-7 mol/L pH=7 显中性 |
12.下列各组物质中,化学键类型和晶体类型都完全相同的是( )
| A. | 干冰和金刚石 | B. | K2CO3和KCl | C. | Na2O和Na2O2 | D. | H2SO4和HCl |
2.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,1 mol Fe与足量稀HNO3反应,转移电子数目一定为为3NA | |
| B. | 0.1 mol/L NaHCO3溶液中含有Na+数目为0.1NA | |
| C. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA | |
| D. | 常温下,1 mol Fe与足量浓硫酸反应,转移电子数目一定为为3NA |
9.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ 的比值将减小(填“增大”、“减小”或“无法确定”).
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(4)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=4;取99mL甲溶液与1mL1mol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=10.
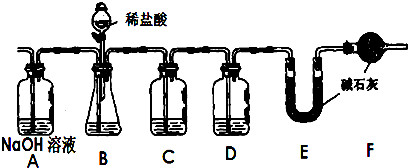
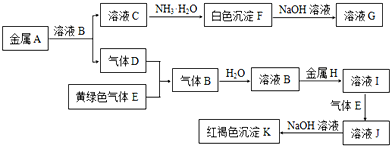
 ,G的化学式是NaAlO2.
,G的化学式是NaAlO2.