题目内容
(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
| A.H2O2的分解反应为放热反应 |
| B.FeCl3是H2O2分解反应的催化剂 |
| C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多 |
| D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同 |
C
解析试题分析:A、因为反应后溶液温度升高,所以H2O2的分解反应为放热反应,正确;B、把FeCl3溶液滴加到H2O2溶液后,产生气体加快,所以FeCl3是H2O2分解反应的催化剂,正确;C、反应放出的热量与是否加入催化剂无关,所以与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量相等,错误;D、H2O2可把FeCl2氧化为FeCl3,所以除溶液颜色变化不同外,其它现象相同,正确。
考点:本题考查影响反应速率的因素。

在一定条件下,反应N2+3H2 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为:
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为:
| A.v(NH3)="0.1" mol/(L·min) | B.v(N2)="0.02" mol/(L·min) |
| C.v(H2)="0.015" mol/(L·min) | D.v(NH3)="0.17" mol/(L·min) |
在一定温度下,10 mL 0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30mol/L
D.反应到6 min时,H2O2分解了50%
一定量的锌粉和6mol·L—1的过量盐酸反应,当向其中加入少量的下列物质:①石墨 ②CuO ③铜粉 ④锌粒 ⑤浓盐酸 ⑥无水乙酸 ⑦KNO3溶液 ⑧CuCl2时,能够加快反应速率,又不响产生H2总量的是 ( )
| A.①③④ | B.②④⑧ | C.①③⑤ | D.①⑤⑦ |
把镁带投入盛有盐酸的敞口容器里,下列因素对反应速率有影响的是
①盐酸的浓度 ②镁带的表面积 ③溶液的温度 ④氯离子的浓度
| A.①② | B.③④ | C.①②③④ | D.①②③ |
已知反应A2(g)+2B2 (g) 2AB2 (g)的ΔH<0,下列说法正确的是( )
2AB2 (g)的ΔH<0,下列说法正确的是( )
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
对于化学反应3W(g)+2X(g)===4Y(g)+3Z (g),下列反应速率关系中,正确的是( )
| A.v(W)=3v(Z) | B.2v(X)=3v(Z) | C.2v(X)=v(Y) | D.3v(W)=2v(X) |
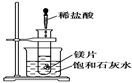
 2C(g),可判断其达到化学平衡状态的是
2C(g),可判断其达到化学平衡状态的是