题目内容
已知反应A2(g)+2B2 (g) 2AB2 (g)的ΔH<0,下列说法正确的是( )
2AB2 (g)的ΔH<0,下列说法正确的是( )
| A.升高温度,正向反应速率增加,逆向反应速率减小 |
| B.升高温度有利于反应速率增加,从而缩短达到平衡的时间 |
| C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 |
| D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
B
解析试题分析:A、升高温度,正逆反应的速率都增加,错误;B、升高温度,反应速率加快,所短到达平衡的时间,正确;C、达到平衡后升高温度,平衡向吸热反应方向移动,对该反应而言,向逆向移动,错误;D、达到平衡后,减小压强,平衡向气体的物质的量增大的方向移动,对该反应而言,向逆向移动,错误,答案选B。
考点:考查温度、压强的改变对反应速率、化学平衡的影响

练习册系列答案
相关题目
汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是
| A.减小压强能增大反应速率 | B.增大压强能减小反应速率 |
| C.使用适当的催化剂能增大反应速率 | D.升高温度对反应速率无影响 |
向恒温、恒容(2L)的密闭容器中充入2molX和一定量的Y,发生反应:2X(g)+Y(g)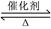 2Z(g)
2Z(g)
ΔH<0,4min后达到平衡c(X)=0.2mol·L-1,且X与Y的转化率相等。下列说法中不正确的是( )
| A.达到平衡时,再充入1molX,反应的焓变保持不变 |
| B.用Y表示4min内的反应速率为0.1 mol·L-1·min-1 |
| C.再向容器中充入1molZ,达到新平衡,c(X)∶c(Y)=2∶1 |
| D.4min后,若升高温度,平衡常数K增大 |
(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
| A.H2O2的分解反应为放热反应 |
| B.FeCl3是H2O2分解反应的催化剂 |
| C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多 |
| D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同 |
已知在一定条件下, 2SO2+O2 2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
| A.大于45.3% | B.小于45.3% | C.等于45.3% | D.无法确定 |
下列四个数据都表示合成氨的反应速率,其中代表同一反应速率的是
①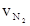 = 0.3mol·L-1·min-1 ②
= 0.3mol·L-1·min-1 ②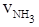 = 0.9 mol·L-1·min-1
= 0.9 mol·L-1·min-1
③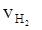 = 0.015 mol·L-1·s-1 ④
= 0.015 mol·L-1·s-1 ④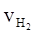 = 2.25 mol·L-1·min-1
= 2.25 mol·L-1·min-1
| A.①② | B.①③ | C.③④ | D.②④ |
下列条件的改变,一定能加快化学反应速率的是
| A.增大压强 | B.升高温度 |
| C.增大反应物的量 | D.减小生成物的浓度 |
 2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )
2NO+O2在体积固定的密闭容器中,达到平衡状态的标志是( )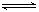 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是