题目内容
对于化学反应3W(g)+2X(g)===4Y(g)+3Z (g),下列反应速率关系中,正确的是( )
| A.v(W)=3v(Z) | B.2v(X)=3v(Z) | C.2v(X)=v(Y) | D.3v(W)=2v(X) |
C
解析试题分析:化学反应速率之比等于化学计量数之比,因此答案选C
考点:考查化学反应速率计算的相关知识点

练习册系列答案
相关题目
(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
| A.H2O2的分解反应为放热反应 |
| B.FeCl3是H2O2分解反应的催化剂 |
| C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多 |
| D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同 |
把下列四种X的溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时X和盐酸缓和地进行反应,其中反应速率最大的是( )
| A.10 mL 2 mol·L-1 | B.20 mL 2 mol·L-1 | C.10 mL 4 mol·L-1 | D.20 mL 3 mol·L-1 |
下列各组反应(表内物质均为反应物)刚开始时,放出H2速率最大的是
| 编号 | 金属(粉末状) | 物质的量 | 酸的浓度 | 酸的体积 | 反应温度 |
| A | Al | 0.1 mol | 18.4 mol/L H2SO4 | 10 mL | 60 ℃ |
| B | Mg | 0.1 mol | 3 mol/L HCl | 10 mL | 30 ℃ |
| C | Fe | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
| D | Mg | 0.1 mol | 3 mol/L H2SO4 | 10 mL | 60 ℃ |
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.生成l mol C的同时生成l mol D | D.气体的总物质的量 |
下列条件的改变,一定能加快化学反应速率的是
| A.增大压强 | B.升高温度 |
| C.增大反应物的量 | D.减小生成物的浓度 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是 ( )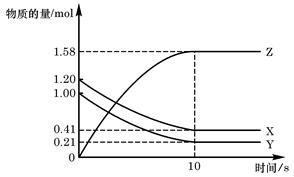
| A.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) |
| B.反应开始到10s, X的物质的量浓度减少了0.79mol/L |
| C.反应开始时10s, Y的转化率为79.0% |
D.反应的化学方程式为:X(g)+ Y(g) Z(g) Z(g) |
 2C(g)达到平衡状态的标志是
2C(g)达到平衡状态的标志是 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是