题目内容
在一定温度下,10 mL 0.40mol/LH2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2 mol/(L·min)
C.反应到6 min时,c(H2O2)=0.30mol/L
D.反应到6 min时,H2O2分解了50%
C
解析试题分析:A.0~6 min的n(O2)=1×10-3mol;则v(H2O2)=2×10-3mol÷0.01L÷6min≈3.3×10-2 mol/(L·min),正确;B.6~10 min的平均反应速率:v(H2O2)=2(26.5-22.4)×10-3L÷22.4L/mol÷0.01L÷2min <3.3×10-2 mol/(L·min),正确;C.反应到6 min时,消耗Δc(H2O2)= 2×10-3mol÷0.01L=0.2mol/L,所以c(H2O2) =0.20mol/L,错误;D.反应到6 min时,由于H2O2分解的物质的量占总的一半,所以分解了50%,正确。
考点:考查化学反应速率和物质的浓度及分解率的计算的知识。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
已知:CO(g) + H2O(g) CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) △H = 。
CH3CH2OH(g) +3H2O(g) △H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。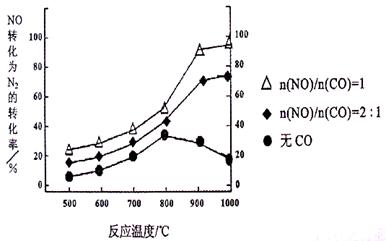
②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g) N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。

在可逆反应2SO2+O2 2SO3中,充入一定量的18O2,足够长的时间后,18O原子
2SO3中,充入一定量的18O2,足够长的时间后,18O原子
| A.只存在于O2中 | B.只存在于O2和SO3中 |
| C.只存在于O2和SO2中 | D.存在于O2、SO2和SO3中 |
25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表,下列说法错误的是
| 物 质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
B.反应可表示为X+3Y
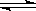 2Z,其平衡常数为1600
2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
向恒温、恒容(2L)的密闭容器中充入2molX和一定量的Y,发生反应:2X(g)+Y(g)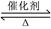 2Z(g)
2Z(g)
ΔH<0,4min后达到平衡c(X)=0.2mol·L-1,且X与Y的转化率相等。下列说法中不正确的是( )
| A.达到平衡时,再充入1molX,反应的焓变保持不变 |
| B.用Y表示4min内的反应速率为0.1 mol·L-1·min-1 |
| C.再向容器中充入1molZ,达到新平衡,c(X)∶c(Y)=2∶1 |
| D.4min后,若升高温度,平衡常数K增大 |
一定条件下,在体积为10L的密闭容器中,1 molX和1 molY发生反应:2x(g)+Y(g) Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
Z(g),经60s达到平衡,生成0.3mol Z。下列说法正确的是
| A.反应进行30 s时,正反应速率等于逆反应速率 |
| B.反应进行80 s时,逆反应速率大于正反应速率 |
| C.反应进行60 s时,X的物质的量浓度为0.04 mol/L |
| D.反应进行60 s时,Y的转化率为70% |
(原创)某课外研究小组的同学将FeCl3(aq)滴加到5%H2O2溶液后,发现产生无色气体由慢到快,最后再变慢;溶液温度升高;同时溶液颜色由黄色立即变为棕褐色,当反应殆尽时,溶液又恢复黄色,由此得出以下结论,你认为错误的是
| A.H2O2的分解反应为放热反应 |
| B.FeCl3是H2O2分解反应的催化剂 |
| C.与不加FeCl3(aq)相比,当H2O2均完全分解时,加FeCl3(aq)使反应放出的热量更多 |
| D.若将少量FeCl2溶液滴入过量5%H2O2溶液中,则除溶液颜色变化不同外,其它现象相同 |
已知在一定条件下, 2SO2+O2 2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
2SO3 反应达平衡后SO2的转化率为45.3%,加入V2O5(催化剂)后,SO2的转化率为
| A.大于45.3% | B.小于45.3% | C.等于45.3% | D.无法确定 |
把下列四种X的溶液,分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时X和盐酸缓和地进行反应,其中反应速率最大的是( )
| A.10 mL 2 mol·L-1 | B.20 mL 2 mol·L-1 | C.10 mL 4 mol·L-1 | D.20 mL 3 mol·L-1 |