题目内容
19.家用消毒液发生器是化学知识在日常生活中的“创新”应用,该发生器利用常见的精盐和自来水为反应物.通电时,器内电解槽的极板上产生大量气泡,切断电源后所得消毒液具有强烈的杀菌能力,且对人体无害.与该反应器直接有关的反应是( )①2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑
②H2+Cl2=2HCl
③Cl2+2NaOH=NaCl+NaClO+H2O
④NaClO+HCl=NaCl+HClO.
| A. | 只有① | B. | ①③ | C. | ①③④ | D. | ①②③④ |
分析 “家用消毒液发生器”的工作原理是电极饱和食盐水生成氢氧化钠、氢气和氯气,氯气在上升过程中与阴极生成的氢氧化钠溶液反应是次氯酸、氯化钠和水,制得有较强杀菌能力的消毒液(NaClO),据此解答.
解答 解:“家用消毒液发生器”的工作原理是电极饱和食盐水生成氢氧化钠、氢气和氯气,氯气在上升过程中与阴极生成的氢氧化钠溶液反应是次氯酸、氯化钠和水,制得有较强杀菌能力的消毒液(NaClO),
发生反应的方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,Cl2+2NaOH=NaCl+NaClO+H2O,
故选:B.
点评 本题考查了“家用消毒液发生器”的原理,明确消毒液的成分及电解原理是解题关键,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
9.已知298K、101KPa条件下
2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
据此判断,下列说法正确的是( )
2H2(g)+O2(g)=2H2O(g)△H1=-483.6kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
据此判断,下列说法正确的是( )
| A. | H2(g)与O2(g)反应生成H2O(g)是吸热反应 | |
| B. | 1 molH2O(g)转变成1 molH2O(l)放出44.0kJ热量 | |
| C. | 1 molH2O(l)转变成1 molH2O(g)放出44.0kJ热量 | |
| D. | 1 molH2O(g)转变成1 molH2O(l)放出88.0kJ热量 |
10.将下列物质的量浓度相等的溶液等体积混合有白色沉淀生成,加入过量稀硝酸后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成的是( )
| A. | 碳酸钠与氢氧化钙 | B. | 碳酸钠与氯化钡 | ||
| C. | 碳酸氢钙与氢氧化钠 | D. | 硫酸钠与氯化钡 |
7.下列离子方程式不正确的是( )
| A. | 在Ba(OH)2溶液中加入过量NaHCO3:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O | |
| B. | 硝酸银溶液与铜:Cu+2Ag+=Cu2++2Ag | |
| C. | 标准状况下2.24LCO2通入1mol/L50mLCa(OH)2溶液中:CO2+OH-=HCO3- | |
| D. | 金属铝溶于稀硫酸溶液:Al+2H+=Al3++H2↑ |
4.下列说法正确的是( )
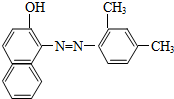

| A. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到,发生了化学反应 | |
| B. | 干馏煤可以得到苯和氨等重要化工原料 | |
| C. | 如图所示物质属于芳香烃 | |
| D. | 如图所示物质能被酸性高锰酸钾氧化 |

 ,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目:
,H2O2在MnO2作催化剂条件下分解的反应方程式并标明电子转移的方向和数目: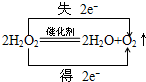 .
.