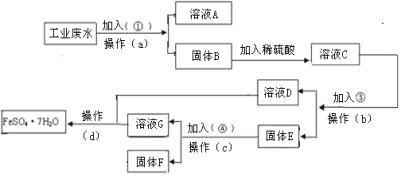
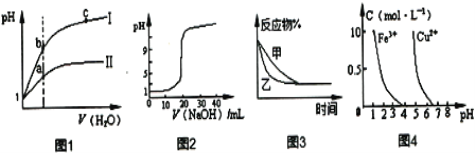
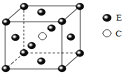
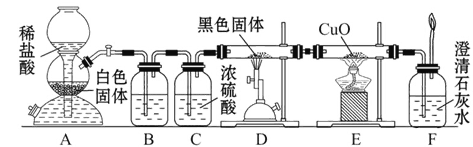
题目内容
【题目】下列说法正确的是( )
A. 若反应X + Y = M是放热反应,该反应一定不用加热。
B. 需要加热方能发生的反应一定是吸热反应。
C. 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
D. CO2与CaO化合是放热反应,则CaCO3分解是吸热反应。
【答案】D
【解析】
A、有的放热反应需加热才能进行,如Fe+S![]() FeS的反应是放热反应,故A错误;B、有的吸热反应不需加热就可以发生,如氯化铵与氢氧化钡晶体的反应,故B错误;C、中和热是指强酸和强碱的稀溶液反应生成1mol水所释放的能量,1mol硫酸与足量氢氧化钠反应生成2mol水,故C错误;D、大多数的化合反应是放热反应,如CO2与CaO化合是放热反应,大多数的分解反应是吸热反应,如CaCO3分解是吸热反应,故D正确;故选D。
FeS的反应是放热反应,故A错误;B、有的吸热反应不需加热就可以发生,如氯化铵与氢氧化钡晶体的反应,故B错误;C、中和热是指强酸和强碱的稀溶液反应生成1mol水所释放的能量,1mol硫酸与足量氢氧化钠反应生成2mol水,故C错误;D、大多数的化合反应是放热反应,如CO2与CaO化合是放热反应,大多数的分解反应是吸热反应,如CaCO3分解是吸热反应,故D正确;故选D。

【题目】(一)在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g) ![]() 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)。
A. N2的转化率越高 B. NH3的产量越大
C. 正反应进行得越彻底 D. 化学反应速度越快
(3)a与b的关系是:a ____ b(填>、<、=)
(二)在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
① | 升高温度 | ______ |
② | 再充入a mol H2 | _______ |
③ | 将容器容积扩大为原来2倍 | _______ |
④ | 容积不变通入b mol Ne(g) | _______ |