题目内容
【题目】下列图示与对应的叙述相符的是
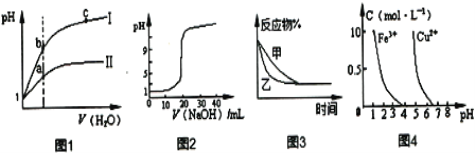
A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且a点溶液的导电性比b点弱
B.图2表示常温时用0.1000mol·L-1NaOH溶液滴定20.00mL 0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C.图3表示压强对反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO,调节PH在4左右
【答案】D
【解析】
A.醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,溶液的导电性与溶液中离子浓度成正比;
B.醋酸是弱电解质,在水溶液里存在电离平衡,导致溶液中氢离子浓度小于醋酸浓度;
C.该反应是一个反应前后气体体积减小的可逆反应,增大压强平衡向正反应方向移动;
D.根据铁离子的浓度和溶液的pH关系知,当pH=4左右时,铁离子浓度几乎为0,而铜离子还没有开始沉淀。
A.醋酸是弱电解质,在水溶液里存在电离平衡,加水稀释促进醋酸电离,氯化氢是强电解质,完全电离,导致稀释过程中,醋酸中氢离子浓度大于盐酸,所以pH变化小的为醋酸,即II为醋酸,溶液的导电性与溶液中离子浓度成正比,a点导电能力大于b,故A错误;
B.醋酸是弱电解质,在水溶液里存在电离平衡,导致溶液中氢离子浓度小于醋酸浓度,所以未滴定时,0.1000mol·L-1CH3COOH溶液中,醋酸的pH>1,故B错误;
C.该反应是一个反应前后气体体积减小的可逆反应,增大压强平衡向正反应方向移动,则反应物的含量减少,该图中改变条件后,反应物的含量不变,说明平衡不移动,加入的是催化剂,故C错误;
D.加入CuO使溶液中的c(H+)减小,c(OH-)浓度增大,使溶液中c(Fe3+)×c3(OH-)>KSP(Fe(OH)3,使Fe3+生成沉淀而除去,故D正确;
故答案选D。

 阅读快车系列答案
阅读快车系列答案