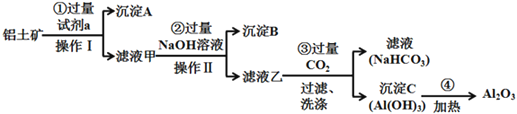
题目内容
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是_____。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJmol-1
2NO2(g) △H=-113.0kJmol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJmol-1
2SO3(g) △H=-196.6kJmol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为_____。
②随温度升高,该反应化学平衡常数变化趋势是____。
(3)提高2SO2+O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是___。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe
b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
【答案】SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4 NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJmol-1 减小 2 bc
【解析】
(1)SO2首先与H2O反应产生H2SO3,然后是H2SO3被氧化产生硫酸;
(2)根据盖斯定律来求解,正反应如果是吸热反应,温度越高K值越大;
(3)①计算出平衡时各种物质的量浓度,带入平衡常数表达式计算平衡常数;
②外界条件改变导致平衡正向移动。
(1)SO2在烟尘的催化下形成硫酸,首先SO2与水反应生成亚硫酸,然后亚硫酸发生氧化反应SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4;
(2)①已知热化学方程式:(i)2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJmol-1
2NO2(g) △H=-113.0kJmol-1
(ii)2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJmol-1
2SO3(g) △H=-196.6kJmol-1
根据盖斯定律用[(ii)- (i)]÷2,整理可得:NO2(g)+SO2(g)=SO3(g)+NO(g) △H=-41.8kJmol-1;
②根据①可知:该反应的正反应为放热反应,根据平衡移动原理:升高温度,化学平衡向吸热的逆反应方向移动,所以升高温度平衡常数减小;
(3)①在T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) ,5min后反应达到平衡,二氧化硫的转化率为50%,则平衡时n(SO2)=n(SO3)=1mol,n(O2)=0.5mol,由于容器的容积是1L,所以物质的平衡浓度:c(SO2)=c(SO3)=1mol/L,c(O2)=0.5mol/L,则该温度下该反应的化学平衡常数K=
2SO3(g) ,5min后反应达到平衡,二氧化硫的转化率为50%,则平衡时n(SO2)=n(SO3)=1mol,n(O2)=0.5mol,由于容器的容积是1L,所以物质的平衡浓度:c(SO2)=c(SO3)=1mol/L,c(O2)=0.5mol/L,则该温度下该反应的化学平衡常数K=![]() =2;
=2;
②a.温度和容器体积不变,充入1.0molHe,由于不能改变任何物质的浓度,所以化学平衡不移动,SO2的转化率不变,a不符合题意;
b.温度和容器体积不变,充入1.0molO2,即增大了反应物O2的浓度,化学平衡正向移动,使SO2的转化率提高,b符合题意;
c.在其他条件不变时,减少容器的体积,相当于增大体系的压强,增大压强,化学平衡向气体体积减小的正反应方向移动,SO2的转化率提高,c符合题意;
d.在其他条件不变时,改用高效催化剂,由于催化剂能够同等倍数的影响正、逆反应速率,所以化学平衡不发生移动,SO2的转化率不变,d不符合题意;
e.在其他条件不变时,升高体系温度,化学平衡向吸热的逆反应方向移动,SO2的转化率降低,e不符合题意;
故合理选项是bc。

【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
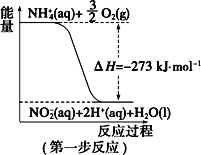
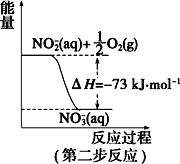
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
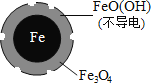
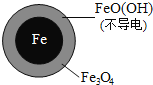
(1)Fe还原水体中NO3-的反应原理如图所示。
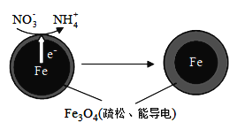
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。