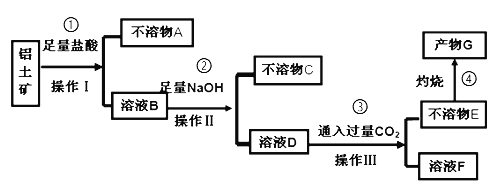
��Ŀ����
����Ŀ��һ���¶��£���3molA�����1molB����ͨ��һ�ܱ������У��������·�Ӧ��3A(g)+B(g)![]() xC(g)����д���пհף�
xC(g)����д���пհף�
(1)����������̶�Ϊ2L����Ӧ2minʱ���ʣ��0.6molB��C��Ũ��Ϊ0.4mol/L��
��2min�ڣ�A��ƽ����Ӧ����Ϊ________��x=_______��
������Ӧ��4min�ﵽƽ�⣬ƽ��ʱC��Ũ��__________0.8mol/L������������������������С����![]() ��
��
(2)��ά������ѹǿ���䣺�ﵽƽ��ʱC���������________22%������������������������С����![]() ��
��
���𰸡�0.3mol/(Lmin) 2 С�� ����
��������
(1)�ټ���μӷ�ӦB�����ʵ������ٸ��ݷ���ʽ����μӷ�ӦA�����ʵ���������v=![]() ����v(A)������n=c��V��������C�����ʵ������������ʵ���֮�ȵ��ڻ�ѧ������֮�ȼ���x��
����v(A)������n=c��V��������C�����ʵ������������ʵ���֮�ȵ��ڻ�ѧ������֮�ȼ���x��
�����ŷ�Ӧ�Ľ��У���Ӧ������С������Ӧ��4min�ﵽƽ�⣬��2min��ƽ������С��ǰ2min��ƽ�����ʣ���2min��C��Ũ�ȱ仯С��0.4mol/L��
(2)��ά������ѹǿ���䣬�ж���������仯����ЧΪѹǿ�仯������ƽ���ƶ�����
(1)��Ӧ2minʱ���ʣ��0.6molB����μӷ�Ӧ��B�����ʵ���n(B)=1mol-0.6mol=0.4mol���ɷ���ʽ��֪�μӷ�Ӧ��A�����ʵ���n(A)=0.4mol��3=1.2mol����v(A)=![]() =
=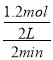 =0.3mol/(Lmin)��C��Ũ��Ϊ0.4mol/L��������C�����ʵ���n(C)=2L��0.4mol/L=0.8mol����0.4mol��0.8mol=1��x����ã�x=2��
=0.3mol/(Lmin)��C��Ũ��Ϊ0.4mol/L��������C�����ʵ���n(C)=2L��0.4mol/L=0.8mol����0.4mol��0.8mol=1��x����ã�x=2��
�����ŷ�Ӧ�Ľ��У���Ӧ������С������Ӧ��4min�ﵽƽ�⣬��2min��ƽ������С��ǰ2min��ƽ�����ʣ�ǰ2min��C��Ũ�ȱ仯Ϊ0.4mol/L�����2min��C��Ũ�ȱ仯С��0.4mol/L����ƽ��ʱC��Ũ��С��0.8mol/L��
(2)��������̶�ʱC���������Ϊ22%�����ڸ÷�Ӧ������Ӧ�����������С�ķ�Ӧ����ά������ѹǿ���䣬��Ӧ��С�������ݻ�����ЧΪ����ѹǿ��������ϵ��ѹǿ����ѧƽ�������������С������Ӧ�����ƶ�����˴ﵽƽ��ʱC�������������22%��

 Сѧ��10���ӿ������100��ϵ�д�
Сѧ��10���ӿ������100��ϵ�д�����Ŀ��ԭ�������������ӵ�ǰ�����ڵ�����Ԫ��A~H���й��������£�
Ԫ�ش��� | A | B | C | D | E | F | G | H |
ԭ�Ӱ뾶/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.114 |
��Ҫ���ϼ� | +1 | +5����3 | ��2 | ��1 | +4����4 | +6����2 | +7����1 | +7����1 |
��֪E�ĵ�����һ�ֳ����İ뵼����ϣ������������ݣ�����Ӧ�Ļ�ѧʽ�ش��й����⣺
��1��Ԫ��A��C��ԭ�Ӹ�����Ϊ1:1�Ļ�����ĵ���ʽΪ_______��
��2��Ԫ��B��C��D�ĵ�һ�������ɴ�С��˳��Ϊ_______
��3��Ԫ��C��F�γɵ�������FC32-�ռ乹��Ϊ_______
��4��Ԫ��G��H����̬�⻯����ȶ�����ǿ����˳��Ϊ________
��5��Ԫ��C��F����̬�⻯��е��ɸߵ��͵�˳��Ϊ______��ԭ����______
��6��Ԫ��E���⻯�EH4������_______����(���������������Ǽ�����)
��7�����Ļ�̬ԭ�Ӽ۵����Ų�ʽΪ______��
��8������[H2NCONH2]�����У�Cԭ�ӵ��ӻ���ʽΪ____��1mol���ط����У���������ĿΪ______��
��9�����������ᾧˮ���Ȼ��������ٻ�ɫ�ľ��壬�仯ѧʽΪ[Fe(H2O)6]Cl3���û������У���Fe3+�γ���λ����ԭ����______��д��H2O��һ�������ӵĵȵ�����______