题目内容
【题目】氮、硒形成的单质及其化合物有重要的科学研究价值,请回答下列问题:
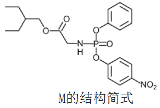
(1)邻氨基吡啶的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。基态氮原子的价电子轨道表示式为______________;其核外电子共占据____个能级;邻氨基吡啶的铜配合物中Cu2+的配位数是_______。

(2)高聚氮晶体结构如图所示,每个氮原子与另外三个氮原子结合形成空间网状结构。固态高聚氮是_______晶体;该晶体中n(N)与n(N—N)之比为_______;这种高聚氮N—N键的键能为160 kJ·mol-1,而N2的键能为942 kJ·mol-1,其可能潜在的应用是__________。

(3)NO3-的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因__________。
(4)硒有三种晶体(α单斜体、β单斜体和灰色三角晶),灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如图所示:

已知正六棱柱的边长为acm,高为bcm,阿伏加德罗常数的值为NA,则该晶体的密度为_____g·cm-3(用含NA、a、b的式子表示)。
【答案】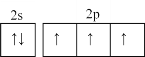 3 4 原子 2:3 制炸药 平面三角形 HNO3中含有非羟基氧多
3 4 原子 2:3 制炸药 平面三角形 HNO3中含有非羟基氧多 ![]()
【解析】
(1)N是7号元素,其核外有7个电子,则基态氮原子的核外电子排布式为1s22s2sp3,价电子轨道表达式为![]() ,其核外电子共占据1s、2s、2p三个能级,由邻氨基吡啶的铜配合物的结构简式分析可知,Cu2+的配位数为4,故答案为:
,其核外电子共占据1s、2s、2p三个能级,由邻氨基吡啶的铜配合物的结构简式分析可知,Cu2+的配位数为4,故答案为:![]() ;3;4;
;3;4;
(2)高聚氮晶体中每个氮原子都通过三个单键和其他氮原子结合并向空间发展构成立体网状结构,属于原子晶体,因为晶体中煤隔氮原子都通过三个单键与其他氮原子结合,则每个氮原子平均形成1.5个N—N键,故氮原子数与N—N键数之比为2:3,则n(N):n(N—N)=2:3,由键能数据分析可知,高聚氮爆炸后生成氮气放出大量的热,还能瞬间生成大量的气体,则可能的用途为制炸药,故答案为:原子;2:3;制炸药;
(3)NO3-中N原子的价电子对数为![]() ,孤电子对数为0,则其空间构型为平面三角形,对于同种元素R的不同的含氧酸的酸性比较,可以把酸写成(HO)nROm的形式,m越大,酸性越强,m越大,非羟基氧个数多,中心原子的电子云向氧偏离的越厉害,从而氢氧键的电子云通过传递向氧偏离的就越厉害,从而容易电离,酸性越小,由于HNO3中的非羟基氧数目比HNO2的多,因此HNO3的酸性更强,故答案为:平面三角形;HNO3中含有非羟基氧多;
,孤电子对数为0,则其空间构型为平面三角形,对于同种元素R的不同的含氧酸的酸性比较,可以把酸写成(HO)nROm的形式,m越大,酸性越强,m越大,非羟基氧个数多,中心原子的电子云向氧偏离的越厉害,从而氢氧键的电子云通过传递向氧偏离的就越厉害,从而容易电离,酸性越小,由于HNO3中的非羟基氧数目比HNO2的多,因此HNO3的酸性更强,故答案为:平面三角形;HNO3中含有非羟基氧多;
(4)Se原子间形成正六棱柱,位于面心与顶点,从晶胞的俯视图可知晶胞中Se原子数目为6×![]() +12×3×
+12×3×![]() =9,体积V=
=9,体积V=![]() ×a2×6×b,
×a2×6×b,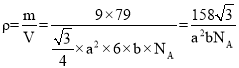 ,故答案为:
,故答案为:![]() 。
。