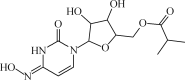
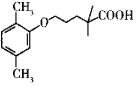
题目内容
【题目】邻苯二甲酸(用H2A表示)为二元弱酸,常温下,Ka1=1.1×10-3,Ka2=3.9×10-6,室温下用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H2A溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A.滴加20 mL NaOH溶液时:c(OH-)>c(H+)+c(H2A )-2c(A2-)
B.pH=7的溶液:c(Na+)<0.050 00 mol·L-1+c(A2-) -c(H2A)
C.滴定过程中可能会出现:c(Na+)>c(HA-)=c(A2-)>c(OH-)>c(H+)
D.滴加40 mL NaOH溶液时:2c(Na+)=c(H2A)+c(A2-)+c(HA-)
【答案】AB
【解析】
A.滴加20 mL 0.100 0 mol·L-1 NaOH溶液时,与20.00 mL 0.100 0 mol·L-1 H2A溶液反应生成NaHA,溶液中存在物料守恒:c(Na+)= c(H2A )+c(A2-)+ c(HA-),电荷守恒为:c(OH-)+2c(A2-)+ c(HA-)= c(Na+)+ c(H+),将物料守恒式代入电荷守恒式可得:c(OH-)=c(H+)+c(H2A )-c(A2-),则c(OH-)>c(H+)+c(H2A )-2c(A2-),故A正确;
B.起始时,0.100 0 mol·L-1 H2A溶液中c(总)= c(H2A )+c(A2-)+c(HA-)=0.1000 mol·L-1,滴入NaOH溶液后,c(H2A )+c(A2-)+c(HA-)<0.1000 mol·L-1,溶液中存在电荷守恒:c(OH-)+2c(A2-)+ c(HA-)=c(Na+)+ c(H+),pH=7的溶液的溶液中,c(OH-)=c(H+),则 2c(A2-)+c(HA-)= c(Na+),c(Na+)<0.1000 mol·L-1+c(A2-)-c(H2A),要是溶液pH=7,加入氢氧化钠的体积大于20mL,离子浓度小于原来的一半,则c(Na+)<0.05000 mol·L-1+c(A2-)-c(H2A)
C.滴加20 mL 0.100 0 mol·L-1 NaOH溶液时,与20.00 mL 0.100 0 mol·L-1 H2A溶液反应生成NaHA,在继续滴加NaOH溶液,可使NaHA转化为Na2A,滴加达到一定体积可使c(HA-)=c(A2-),已知,Ka2=3.9×10-6,则Kh(HA-)=![]() <Ka2,则溶液中HA-电离程度大于水解程度,溶液显酸性,则c(OH-)<c(H+),故C错误;
<Ka2,则溶液中HA-电离程度大于水解程度,溶液显酸性,则c(OH-)<c(H+),故C错误;
D.滴加40 mL NaOH溶液时,20.00 mL 0.100 0 mol·L-1 H2A溶液完全反应生成Na2A,溶液中存在物料守恒:c(Na+)=2[c(H2A)+c(A2-)+c(HA-)],故D错误;
答案选AB。

 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案【题目】第Ⅷ族元素![]() 、
、![]() 、
、![]() 性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
性质相似,称为铁系元素,主要用于制造合金。回答下列问题:
(1)基态![]() 原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与
原子核外能量最高的电子位于_______能级,同周期元素中,基态原子未成对电子数与![]() 相同的元素名称为______________。
相同的元素名称为______________。
(2)![]() 与酚类物质的显色反应常用于其离子检验,已知
与酚类物质的显色反应常用于其离子检验,已知![]() 遇邻苯二酚(
遇邻苯二酚(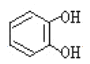 )和对苯二酚(
)和对苯二酚(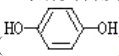 )均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
)均显绿色。邻苯二酚的熔沸点比对苯二酚_____(填“高”或“低”),原因是_________。
(3)有历史记载的第一个配合物是![]() (普鲁士蓝),该配合物的内界为__________。表为
(普鲁士蓝),该配合物的内界为__________。表为![]() 、
、![]() 不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,
不同配位数时对应的晶体场稳定化能(可衡量形成配合物时,总能量的降低)。由表可知,![]() 比较稳定的配离子配位数是__________(填“4”或“6”)。
比较稳定的配离子配位数是__________(填“4”或“6”)。![]() 性质活泼,易被还原,但
性质活泼,易被还原,但![]() 很稳定,可能的原因是________________。
很稳定,可能的原因是________________。
离子 | 配位数 | 晶体场稳定化能(Dq) |
| 6 | -8Dq+2p |
4 | -5.34Dq+2p | |
| 6 | -12Dq+3p |
4 | -3.56Dq+3p |
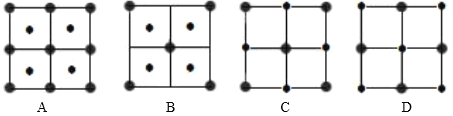
(4)![]() 晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为
晶体结构中阴阳离子的配位数均为6,则晶胞的俯视图可能是_______(填选项字母)。若晶胞参数为apm,阿伏加德罗常数的值为![]() ,晶体的密度是________
,晶体的密度是________![]() 。
。
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D