题目内容
【题目】(一)在微生物作用的条件下,NH4+经过两步反应被氧化成 NO3-。两步反应的能量变化示意图如下:
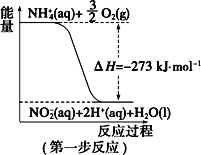
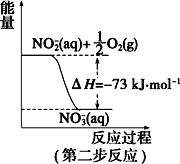
(1)第一步反应是_________(填“放热”或“吸热”)反应。
(2)1 mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式是___________。
(二)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
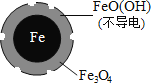
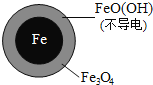
(1)Fe还原水体中NO3-的反应原理如图所示。
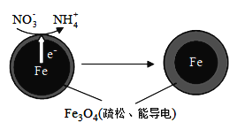
①作负极的物质化学式为___________。
②正极的电极反应式是_______________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_______________。
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3-的去除率。对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3-;
Ⅱ.Fe2+破坏FeO(OH)氧化层。
①做对比实验,结果如图所示,可得到的结论是_________。

②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4,该反应的离子方程式为_________解释加入Fe2+提高NO3-去除率的原因:________。
【答案】放热 ![]() (aq)+2O2(g)=NO
(aq)+2O2(g)=NO![]() (aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 Fe NO3-+8e-+10H+=NH4++3H2O FeO(OH)不导电,阻碍电子转移 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 Fe2++2FeO(OH)=Fe3O4+2H+ Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移
(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ·mol-1 Fe NO3-+8e-+10H+=NH4++3H2O FeO(OH)不导电,阻碍电子转移 本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率 Fe2++2FeO(OH)=Fe3O4+2H+ Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移
【解析】
(一)(1)根据图象可知,第一步反应的反应物能量高于生成物;(2)1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到;
(二)(1)①Fe还原水体中NO3-,根据题意Fe3O4为电解质,则Fe作还原剂,失去电子,作负极;②NO3-在正极得电子发生还原反应产生NH4+,据此书写电极反应式;
(2)由于Fe3O4为电解质,而电解质的主要作用是为电子转移提供媒介,结合FeO(OH)不导电分析解答;
(3)①根据图中的三个实验结果进行分析,单独加入Fe2+时,NO3-的去除率为0,而Fe和Fe2+共同加入时NO3-的去除率比单独加入Fe高;②结合铁的最终物质形态的导电差异分析解答。
(一)(1)根据图象可知,第一步反应中反应物能量高于生成物,依据能量守恒分析可知反应为放热反应,故答案为:放热;
(2)1mol NH4+(aq)全部氧化成NO3-(aq)可由两步反应加和得到,热化学方程式为NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=(-273kJ/mol)+(-73kJ/mol)=-346kJ/mol,故答案为:NH4+(aq)+2O2(g)=2H+(aq)+H2O(l)+NO3-(aq)△H=-346kJ/mol
(二)(1)①Fe还原水体中NO3-,Fe3O4为电解质,则Fe作还原剂,失去电子,作负极,故答案为:铁;
②NO3-在正极得电子,发生还原反应产生NH4+,则正极的电极反应式为:NO3-+8e-+10H+=NH4++3H2O,故答案为:NO3-+8e-+10H+=NH4++3H2O;
(2)根据实验,pH越高,Fe3+越易水解生成FeO(OH),而FeO(OH)不导电,将铁全部覆盖,阻碍电子转移,所以NO3-的去除率低,故答案为:FeO(OH)不导电,阻碍电子转移;
(3)①从实验结果可以看出,单独加入Fe2+时,NO3-的去除率为0,因此得出Fe2+不能直接还原NO3-;而Fe和Fe2+共同加入时NO3-的去除率比单独加入Fe高,因此可以得出结论:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率,故答案为:本实验条件下,Fe2+不能直接还原NO3-;在Fe和Fe2+共同作用下能提高NO3-的去除率;
②同位素示踪法证实了Fe2+能与FeO(OH)反应生成Fe3O4,反应的离子方程式为:Fe2++2FeO(OH)=Fe3O4+2H+,Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移,因此加入Fe2+可以提高NO3-去除率,故答案为:Fe2++2FeO(OH)=Fe3O4+2H+;Fe2+将不导电的FeO(OH)转化为可导电的Fe3O4,利于电子转移。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下列实验结论与实验操作及现象相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A. | 向某溶液中加入HCl 溶液,产生的气体使澄清的石灰水变浑浊 | 该溶液中含有CO32- |
B. | 向某溶液中通入Cl2,再加入KSCN溶液,溶液变红 | 该溶液中一定含有Fe2+ |
C. | 铁粉加入CuSO4溶液中,析出红色固体 | 氧化性:Fe2+ > Cu2+ |
D. | 向FeCl3溶液中滴加浓的维生素C溶液,黄色褪去 | 维生素C具有还原性 |
A.AB.BC.CD.D