题目内容
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
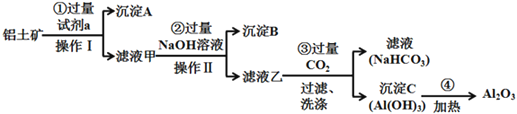
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH-=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________;
【答案】SiO2 Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO2-+2H2O CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓
【解析】
根据工艺流程得出试剂a为盐酸,氧化铝、氧化铁与盐酸反应生成氯化铝和氯化铁,而二氧化硅和盐酸不反应,沉淀A为二氧化硅,滤液中有氯化铝、氯化铁、过量盐酸,再加氢氧化钠溶液,得到氢氧化铁沉淀和偏铝酸钠溶液,过滤,沉淀B为氢氧化铁,滤液为偏铝酸钠与二氧化碳反应生成氢氧化铝和碳酸氢钠溶液,氢氧化铝加热变为氧化铝。
(1)二氧化硅不与盐酸反应,因此沉淀A的成分是(填化学式) SiO2,故答案为:SiO2。
(2)步骤②滤液主要是氯化铝、氯化铁、过量盐酸,加入过量NaOH溶液,先发生酸碱中和反应,再与铁离子和铝离子反应,发生反应的离子方程式,除了H++OH- = H2O还有:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O;故答案为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O。
(3)步骤③中通入过量CO2气体,先氢氧化钠和二氧化碳反应,再是偏铝酸钠和二氧化碳反应生成碳酸氢钠和氢氧化铝,其离子方程式有CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓,故答案为:CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7