题目内容
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.脱氯反应为S2O32-+Cl2+H2O→SO42-+Cl-+H+(未配平).下列对该反应的说法不正确的是( )
| A、反应中硫元素发生了氧化反应 |
| B、脱氯反应后的溶液显酸性 |
| C、根据该反应可判断还原性:S2O32->Cl- |
| D、反应中每脱去1mol Cl2会生成1mol SO42- |
考点:氧化还原反应
专题:氧化还原反应专题
分析:S2O32-+Cl2+H2O→SO42-+Cl-+H+中,S元素的化合价由+2价升高为+6价,Cl元素的化合价由0降低为-1价,以此来解答.
解答:
解:A.S元素的化合价升高,发生氧化反应,故A正确;
B.由反应可知生成氢离子,酸性增强,故B正确;
C.由还原剂的还原性大于还原产物的还原性可知,还原性:S2O32->Cl-,故C正确;
D.反应中每脱去1mol Cl2会转移2mol电子,由电子守恒可知生成
=0.25mol SO42-,故D错误;
故选D.
B.由反应可知生成氢离子,酸性增强,故B正确;
C.由还原剂的还原性大于还原产物的还原性可知,还原性:S2O32->Cl-,故C正确;
D.反应中每脱去1mol Cl2会转移2mol电子,由电子守恒可知生成
| 2mol |
| 2×(6-2) |
故选D.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于某些社会热点问题的说法中,不正确的是( )
| A、光化学烟雾的产生与碳氢化合物、氮氧化物的排放有关 |
| B、禁止使用含铅汽油是为了提高汽油的燃烧效率 |
| C、臭氧空洞的形成与氟氯烃或氮氧化物泄漏到大气中有关 |
| D、甲醛是某些劣质装饰板材释放的常见污染物之一 |
下列说法正确的是( )
| A、相同物质的量浓度时,溶液中c(NH4+)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3?H2O |
| B、为了确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C、0.2mol?L-1的CH3COONa溶液与0.1mol?L-1的HCl等体积混合呈酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) |
| D、相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③ |
下列说法正确的是( )
| A、金属钠着火可用煤油扑灭 |
| B、将几滴FeCl3饱和溶液滴入氢氧化钠溶液可制备Fe(OH)3胶体 |
| C、向含有等量NaI、NaCl的溶液中滴加AgNO3溶液,先产生白色沉淀 |
| D、用浓氢氧化钠溶液和湿润红色石蕊试纸检验某溶液中是否有NH4+ |
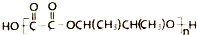 的合成路线流程图(无机试剂任用).合成路线流程图如图:
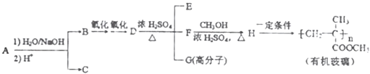
的合成路线流程图(无机试剂任用).合成路线流程图如图: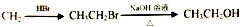
 根据氧化还原反应:Zn(s)+2Ag+(aq)═Zn2+(aq)+2Ag(s),试设计一个简单的原电池.
根据氧化还原反应:Zn(s)+2Ag+(aq)═Zn2+(aq)+2Ag(s),试设计一个简单的原电池.