题目内容
 根据氧化还原反应:Zn(s)+2Ag+(aq)═Zn2+(aq)+2Ag(s),试设计一个简单的原电池.
根据氧化还原反应:Zn(s)+2Ag+(aq)═Zn2+(aq)+2Ag(s),试设计一个简单的原电池.(1)在方框中画出此原电池的装置简图,并注明原电池的正极和负极以及外电路中电子流向.(在装置图中标出);
(2)写出正极上的电极反应:
考点:设计原电池
专题:电化学专题
分析:根据Zn(s)+2Ag+(aq)═Zn2+(aq)+2Ag(s)中元素化合价变化知,Zn作负极,不如锌活泼的金属或导电的非金属作正极,含有银离子的可溶性盐作电解质,如硝酸银溶液作电解质溶液,电子从负极沿导线流向正极.
解答:
解:(1)根据Zn(s)+2Ag+(aq)═Zn2+(aq)+2Ag(s)中元素化合价变化知,Zn作负极,不如锌活泼的金属或导电的非金属作正极,含有银离子的可溶性盐作电解质,电子从负极沿导线流向正极,所以其装置图为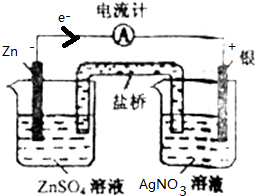 ,
,
故答案为: ;
;
(2)正极上银离子得电子发生还原反应,电极反应为Ag++e-=Ag,故答案为:Ag++e-=Ag.
 ,
,故答案为:
 ;
;(2)正极上银离子得电子发生还原反应,电极反应为Ag++e-=Ag,故答案为:Ag++e-=Ag.
点评:本题考查了原电池设计,为学生需要掌握的知识点,根据电池反应式中得失电子确定正负极、电解质溶液,知道盐桥的作用及盐桥中阴阳离子移动方向,题目难度不大.

练习册系列答案
相关题目
Cl2是纺织工业中常用的漂白剂,Na2S2O3可作漂白布匹后的“脱氯剂”.脱氯反应为S2O32-+Cl2+H2O→SO42-+Cl-+H+(未配平).下列对该反应的说法不正确的是( )
| A、反应中硫元素发生了氧化反应 |
| B、脱氯反应后的溶液显酸性 |
| C、根据该反应可判断还原性:S2O32->Cl- |
| D、反应中每脱去1mol Cl2会生成1mol SO42- |
t℃时CuSO4的溶解度是S g,其饱和溶液密度d g.cm-3、物质的量浓度为c mol.L-1.向足量饱和溶液中加入m g无水CuSO4或蒸发掉n g水后恢复t℃,均能获得W g胆矾晶体,下列关系式正确的是( )
A、c=
| ||
B、S=
| ||
C、m=
| ||
D、W=
|
下列物质的水溶液,加热蒸干得到原物质的是( )
①NaAlO2 ②FeCl3 ③CuSO4 ④FeSO4 ⑤Na2S ⑥Ca(HCO3)2 ⑦NaClO ⑧NH4I ⑨Na2SO3 ⑩CaCl2.
①NaAlO2 ②FeCl3 ③CuSO4 ④FeSO4 ⑤Na2S ⑥Ca(HCO3)2 ⑦NaClO ⑧NH4I ⑨Na2SO3 ⑩CaCl2.
| A、①③⑤⑥⑧⑩ |
| B、②③④⑤⑨⑩ |
| C、①③⑤⑩ |
| D、③⑤⑦⑩ |
 如图为一个电化学过程的示意图.请回答下列问题:
如图为一个电化学过程的示意图.请回答下列问题: