题目内容
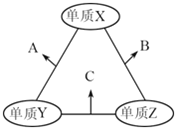
【题目】已知:
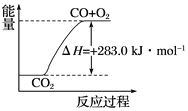
① CO(g)+ ![]() O2(g)=CO2(g) ΔH= -283.0 kJ·mol-1
O2(g)=CO2(g) ΔH= -283.0 kJ·mol-1
② H2(g)+ ![]() O2(g)=H2O(g) ΔH= -241.8 kJ·mol-1
O2(g)=H2O(g) ΔH= -241.8 kJ·mol-1
下列说法正确的是( )
A. 1mol H-H键与0.5mol O=O键的键能之和大于2mol H-O 键的键能总和
B. 由①可知,1 mol CO(g)和 ![]() mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
mol O2(g)反应生成 1 mol CO2(g),放出283.0 kJ的热量
C. 可用上图表示 2CO2(g)=2CO(g)+O2(g) 反应过程中的能量变化关系
D. 分解1 mol H2O(g),其反应热为-241.8 kJ
【答案】B
【解析】
A、根据反应②,氢气和氧气反应生成水是放热反应,因此1mol H-H键与0.5mol O=O键的键能之和小于2mol H-O 键的键能总和,故A错误;
B、热化学方程式①可知表示的意义是1mol一氧化碳和0,5mol氧气完全反应生成1mol二氧化碳放热283kJ,符合热化学方程式的含义,故B正确;
C、图中忽视了化学计量数与反应热的定量关系,应该注明各物质的物质的量,故C错误;
D、根据反应②,分解水是生成水的逆过程,分解1mol水需要吸收241.8kJ的热量,即反应热为-241.8 kJ·mol-1,故D错误;
答案选B。

【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)SO2有毒,且能形成酸雨,是大气主要污染物之一。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收原理:
①SO2+Ca(OH)2=CaSO3↓+H2O②2CaSO3+O2+4H2O=2(CaSO4·2H2O)碱法的吸收原理:将含SO2的尾气通入足量的烧碱溶液中,请写出对应的化学反应方程式__________;
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
和石灰-石膏法相比,碱法的优点是吸收快、效率高,缺点是__________;
(2)石灰-石膏法和碱法的基础上,设计了双碱法,能实现物料循环利用。

上述方法中,实现循环利用的物质是__________,请用化学方程式表示在Na2SO3溶液中加入CaO后的反应原理__________。
(3)一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________
(4)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。i.SO2+4I-+4H+![]() S↓+2I2+2H2O ii.I2+2H2O+SO2
S↓+2I2+2H2O ii.I2+2H2O+SO2![]() SO42- +4H++2I-
SO42- +4H++2I-
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
下列说法不正确的是( )
A. 水溶液中SO2歧化反应方程式为3SO2+2H2O ![]() 2H2SO4 +S↓
2H2SO4 +S↓
B. II是I的对比实验,则a=0.4
C. 比较I、II、III,可得出的结论是:I是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
D. 实验表明,SO2的歧化反应速率IV>I,原因是反应i比ii快;IV中由反应ii产生的H+使反应i加快