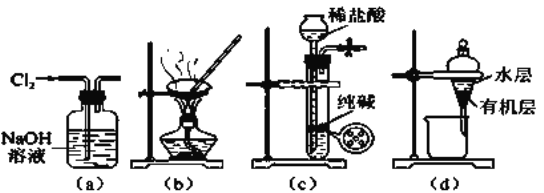
题目内容
【题目】常温下,在新制氯水中滴加NaOH 溶液,溶液中水电离出来的c水(H+)的对数与NaOH 溶液体积之间的关系如图所示。下列推断正确的是

A. 用pH试纸测定E点对应的溶液,其pH=3
B. F、H点对应的溶液中都存在c(Na+)=c(Cl-)+c(ClO-)
C. G点对应的溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
D. 加水稀释H点对应的溶液,溶液的pH增大
【答案】C
【解析】向新制氯水中滴加氢氧化钠溶液生成氯化钠、次氯酸钠和水,水的电离程度逐渐增大,当恰好反应时再滴加氢氧化钠,氢氧化钠是强碱,抑制水的电离,结合水的电离、盐类水解以及电荷守恒、物料守恒等分析判断。
A. 新制氯水具有强氧化性,能漂白酸碱指示剂,不能用pH试纸测定E点对应的溶液pH,A错误;
B. 根据图像可知G点恰好反应,所以F点水的电离程度大于H点水的电离程度,H点溶液显碱性,因此H点的溶液中存在c(Na+)>c(Cl-)+c(ClO-),B错误;
C. G点对应的溶液中含有氯化钠、次氯酸钠,次氯酸根水解,则溶液中c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),C正确;
D. H点氢氧化钠过量,溶液显碱性,加水稀释H点对应的溶液,氢氧根浓度减小,溶液的pH减小,D错误。答案选C。

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目