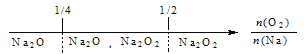题目内容
【题目】有X、Y、Z三种短周期元素,原子半径由大到小的顺序为Y>X>Z,原子序数之和为16.三种元素的常见单质在适当条件下可发生如图所示的变化,其中B和C均为10电子分子.有关判断不正确的是( )
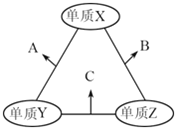
A. X元素位于ⅥA族 B. A不能溶解于B中 C. B的沸点高于C的沸点 D. A和C不可能发生氧化还原反应
【答案】D
【解析】B和C为化合物,且属于10电子分子,说明是氢化物,可能是HF、H2O、NH3、CH4中的两个,根据原子半径顺序,Z为H,原子序数之和为16,且单质X和单质Y能发生反应,即Y为N,X为O,A、根据上述分析,X为O,位于第二周期第VIA族,故A说法正确;B、A为NO,B为H2O,NO不溶于水,故B说法正确;C、H2O常温下为液态,C为NH3,常温下为气态,因此H2O的沸点高于NH3,故C说法正确;D、NO和NH3一定条件下的反应是6NO+4NH3=5N2+6H2O,故D说法错误。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目