题目内容
17.某有机化合物A对H2的相对密度为29,燃烧该有机物2.9g,生成标准状况下3.36L二氧化碳气体密度为1.963.(1)求该有机物的分子式;
(2)取0.58g该有机物与足量的银氨溶液反应,析出金属银2.16g,则该有机化合物的结构简式为CH3CH2CHO.
分析 (1)有机化合物A对氢气的相对密度为29,则A的相对分子质量=29×2=58,计算二氧化碳的物质的量,根据质量守恒判断有机物是否含有氧元素,若有氧元素,计算氧元素质量,进而计算2.9gA中氧原子物质的量,确定有机物A的最简式,再结合相对分子质量确定其分子式;
(2)0.58g该有机物的物质的量=$\frac{0.58g}{58g/mol}$=0.01mol,与足量银氨溶液反应,析出金属银2.16g,2.16gAg的物质的量=$\frac{2.16g}{108g/mol}$=0.02mol,有机物A与生成Ag的物质的量之比=0.01mol:0.02mol=1:2,故有机物A分子中含有1个-CHO,结合有机物A的分子式书写其结构简式.
解答 解:(1)有机化合物的蒸汽的密度是同条件下氢气的29倍,有机物的相对分子质量=29×2=58,
燃烧该有机物2.9g,生成3.36L二氧化碳气体(标况下),则二氧化碳物质的量=$\frac{3.36L}{22.4L/mol}$=0.15mol,故C元素的质量为:0.15mol×12g/mol=2.1g,
由题意可知A的相对分子质量为2×29=58,2.9克A,就为0.05mol,因为生成二氧化碳0.15摩,所以原有机物中有0.15摩碳元素
所以可知A的分子式中含有碳$\frac{0.15}{0.05}$=3个
3个碳的相对质量为36,所以还有22
若这22全部为H是不可能的
若是有8个氢,则还剩下14,显然不足一个氧
所以最终只能是有6个氢和1个氧,故有机物A的分子式为C3H6O,
答:有机物A的分子式为C3H6O;
(2)0.58g该有机物的物质的量=$\frac{0.58g}{58g/mol}$=0.01mol,与足量银氨溶液反应,析出金属银2.16g,2.16gAg的物质的量=$\frac{2.16g}{108g/mol}$=0.02mol,有机物A与生成Ag的物质的量之比=0.01mol:0.02mol=1:2,故有机物A分子中含有1个-CHO,则有机物A的结构简式为:CH3CH2CHO,
故答案为:CH3CH2CHO.
点评 本题考查有机物分子式确定、醛的性质等,难度不大,注意掌握醛与银氨溶液反应中醛基与Ag的物质的量关系.

| A. | 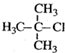 2-甲基-2-氯丙烷 | B. | 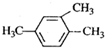 1,3,4-三甲苯 | C. | 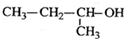 2-甲基-1-丙醇 | D. | 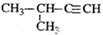 2-甲基-3-丁炔 |

| A. | 该方案能够计算出“钾泻盐”中KCl的质量分数 | |
| B. | 足量Ba(NO3)2溶液是为了与MgSO4充分反应 | |
| C. | “钾泻盐”化学式中x=3 | |
| D. | 上述实验数据的测定利用学校实验室里的托盘天平即可完成 |
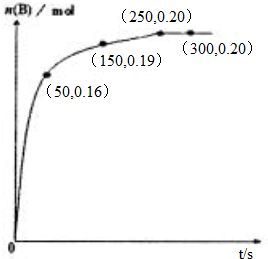
| A. | 0~50秒,A物质化学反应速率v(A)=0.0016mo 1•L-1•S-1 | |
| B. | 250s时该反应达到化学平衡状态 | |
| C. | 若改加入2.0mol A,A的平衡转化率大于20% | |
| D. | 300K时,该反应的平衡常数为0.025 mol•L-1 |
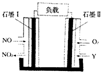 以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )
以NO、O2,熔融NaNO3,组成的燃料电池装置如图所示,在使用过程中石墨I生成NO2,Y为一种氧化物,下列说法不正确的是( )| A. | 石墨Ⅱ电极为正极 | |
| B. | Y为N2O5 | |
| C. | 石墨Ⅰ电极方程式为NO+O2--2e-=NO2 | |
| D. | 不能用NaNO3水溶液代替熔融NaNO3 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)在最高价氧化物的水化物中碱性最强的化合物的是KOH
(3)写出⑤的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)用电子式表示元素④与⑥的化合物的形成过程:
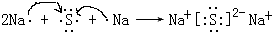
(5)③、⑥的氢化物中,沸点较高的是H2O(用化学式表示) 原因是水分子之间含氢键.
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.