题目内容
【题目】为迎接G20峰会的到来,浙江加大了对环境治理的力度。其中对含氮化物的处理是一个重要的课题。
Ⅰ.氮氧化物
(1)已知:N2(g)和O2(g)反应生成NO(g)过程中的能量变化情况如下

①2NO(g) ![]() N2(g)+O2(g) △H=_______________
N2(g)+O2(g) △H=_______________
②你认为该反应能否自发,并说明理由____________________________________
(2)科学家利用2NO(g) ![]() N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________
N2(g)+O2(g)来消除NO的污染。1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol。在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,第25min时到达平衡;第30min时,保持温度和体积不变,向容器中再通入0.2molNO,第50min时达到平衡,请在右图中画出从第15min起到70minNO的物质的量随时间变化的曲线。_________

Ⅱ.亚硝酸盐
(1)来源:用氧化性熔融盐处理钢铁表面氧化膜时会产生污染物亚硝酸盐,请写出FeO与NaNO3在加热条件下发生的反应________________________。
(2)电化学处理:用电解法降解NO2其原理如下图所示电源正极为_______(填A或B),阴极反应式为__________________________________ 。

【答案】-180kJ/mol该反应△H<0,若△S>0则反应一定自发;若△S<0则反应在低温下自发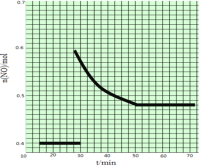 2FeO+NaNO3
2FeO+NaNO3![]() Fe2O3+NaNO2A2NO2-+6e-+4H2O=N2↑+8OH-
Fe2O3+NaNO2A2NO2-+6e-+4H2O=N2↑+8OH-
【解析】
Ⅰ.(1).①.2NO(g)![]() N2(g)+O2(g),反应热等于反应物的键能总和-生成物的键能总和;②.如能自发进行,应满足△H-T△S<0;
N2(g)+O2(g),反应热等于反应物的键能总和-生成物的键能总和;②.如能自发进行,应满足△H-T△S<0;
(2). 对于2NO(g) ![]() N2(g)+O2(g),1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol,在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,因反应前后气体物质的量不变,则平衡不移动,第30min时,保持温度和体积不变,向容器中再通入0.2molNO,NO的物质的量浓度增大,平衡正向移动,但达到平衡时,各物质的百分含量不变,则第50min时达到平衡,NO的物质的量应变为0.48mol;
N2(g)+O2(g),1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol,在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,因反应前后气体物质的量不变,则平衡不移动,第30min时,保持温度和体积不变,向容器中再通入0.2molNO,NO的物质的量浓度增大,平衡正向移动,但达到平衡时,各物质的百分含量不变,则第50min时达到平衡,NO的物质的量应变为0.48mol;
Ⅱ.(1).FeO与NaNO3在加热条件下发生反应生成氧化铁和亚硝酸钠;(2).据图可知,用电解法降解NO2-时,NO2-在阴极被还原生成氮气,则A为正极,B为负极。
Ⅰ.(1).①.2NO(g) ![]() N2(g)+O2(g),反应热等于反应物的键能总和生成物的键能总和,△H=(2×632kJ/mol)(946kJ/mol+498kJ/mol)=180kJ/mol,故答案为:180kJ/mol;
N2(g)+O2(g),反应热等于反应物的键能总和生成物的键能总和,△H=(2×632kJ/mol)(946kJ/mol+498kJ/mol)=180kJ/mol,故答案为:180kJ/mol;
②.如能自发进行,应满足△HT△S<0,该反应的△H<0,所以若△S>0则反应一定自发,若△S<0则反应在低温下自发,故答案为:该反应△H<0,若△S>0则反应一定自发;若△S<0则反应在低温下自发;
(2).1molNO在恒温、容积恒定为1L的密闭容器中反应,10min后达到平衡,NO的物质的量为0.4mol,在第15min时,保持温度不变,将容器的体积迅速增大至2L并保持恒容,因反应前后气体物质的量不变,则平衡不移动,第30min时,保持温度和体积不变,向容器中再通入0.2molNO,NO物质的量浓度增大,平衡正向移动,但达到平衡时,各物质的百分含量不变,第50min时达到平衡,NO的物质的量应变为0.48mol,则图象为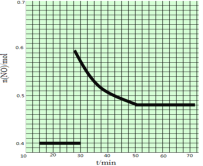 ,故答案为:
,故答案为: ;
;
Ⅱ.(1).FeO与NaNO3在加热条件下发生反应生成氧化铁和亚硝酸钠,根据得失电子守恒和原子守恒配平后的化学方程式为2FeO+NaNO3![]() Fe2O3+NaNO2,故答案为:2FeO+NaNO3
Fe2O3+NaNO2,故答案为:2FeO+NaNO3![]() Fe2O3+NaNO2;
Fe2O3+NaNO2;
(2).用电解法降解NO2-其原理如图所示,NO2-在阴极被还原生成氮气,则A为正极,B为负极,阴极反应式为2NO2+6e+4H2O=N2↑+8OH,故答案为:A;2NO2-+6e-+4H2O=N2↑+8OH-。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案