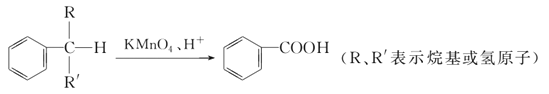
题目内容
【题目】如图所示为元素周期表的一部分,下列有关短周期元素X、Y、Z、W的说法中,正确的是( )

A. 元素X的最低化合价的绝对值与其最高化合价之和为8
B. 最高价氧化物对应的水化物的酸性:H2WO4>HZO4
C. 气态氢化物的稳定性:H2Y>H2W
D. 原子半径:Z>W>Y>X
【答案】C
【解析】
根据元素在周期表中的位置可知,X为F元素,Y为O元素,Z为Cl元素,W为S元素,结合元素周期律分析解答。
A. X为F元素,F的非金属性最强,没有最高正价,故A错误;
B. 元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性W<Z,最高价含氧酸的酸性:H2WO4<HZO4,故B错误;
C. 元素的非金属性越强,气态氢化物越稳定,非金属性Y>W,气态氢化物的稳定性:H2Y>H2W,故C正确;
D. 一般而言,电子层数越多,原子半径越大;电子层数相同的原子,原子序数越大,原子半径越小,原子半径:W>Z>Y>X,故D错误;
答案选C。

【题目】Ⅰ.汽车尾气排放的NOX和CO污染环境,在汽车尾气系统中安装催化转化器,可有效降低NOX和CO的排放。
已知:①2CO(g)+O2(g)![]() 2CO2(g), △H=-566.0kJ·mol-1
2CO2(g), △H=-566.0kJ·mol-1
②N2(g)+O2(g)![]() 2NO(g)△H=+180.5 kJ·mol-1
2NO(g)△H=+180.5 kJ·mol-1
回答下列问题:
(1)CO的燃烧热为___________,若1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收946kJ、498kJ的能量,则1molNO(g)分子中化学键断裂时需吸收的能量为___________kJ。
(2)为了模拟反应2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
2CO2(g)+N2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用传感器测得不同时间NO和CO的浓度如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(10-4 kJ·mol-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(10-3kJ·mol-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)___________。
②能说明上述反应达到平衡状态的是___________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
(3)在某恒容容器中发生下列反应:2NO2(g)![]() 2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。
2NO(g)+O2(g),将一定量的NO2放入恒容密闭容器中,测得其平衡转化率随温度变化如图所示。

该反应为___________反应(填“吸热”或“放热”),已知图中a点对应温度下,NO2的起始压强P0为120kPa,计算该温度下反应的平衡常数Kp的值为___________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
Ⅱ.N2H4-O2燃料电池是一种高效低污染的新型电池,其装置如图所示:

N2H4的电子式为___________;a极的电极反应方程式为___________;
【题目】下列根据实验操作和现象所得出的结论,错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min 后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
B | 常温下,向浓硝酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硝酸反应 |
C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点;氧化铝>铝 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
A. A B. B C. C D. D
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表:
X | Y | Z | M | R | Q | |
原子半径/nm | 0.099 | 0.186 | 0.074 | 0.143 | ||
主要化合价 | +4,-4 | -2 | -1,+7 | +3 | ||
其他 | 常温下为黄色固体 | 无机非金属材料的主角 | 颜色反应为黄色 | 其氧化物可做耐火材料 |
(1)Q在元素周期表中的位置是______.
(2)Y与R相比,非金属性较强的是________(用元素符号表示),下列事实能证明这一结论的是______(填字母序号)
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性:HR>YH4
c.Y与R形成的化的中Y呈正价
(3)根据表中数据推测,Y的原子半径的最小范围是______.
(4)甲、乙是上述某些元素的最高价氧化物对应的水化物,且甲+乙→丙+水.若丙的水溶液呈碱性,则丙的化学式是______.
(5)已知1mo1XM2(g)被氧化为1mo1XM3(g)的△H=﹣99kJ/mo1.写出由XM2生成XM3的热化学反应方程式 ________。